
League of Chemistry
Apuntes Teoricos
Apuntes Teoricos
I. Generalidades de la geometría Generalidades molecular
El estado sólido la geometría molecular puede ser medido por Difracción de rayos X. Las geometrías se pueden calcular por procedimientos mecánico cuánticos ab initio o por métodos semiempíricos de modelamiento molecular. Suelen estar unidos unos a otros con enlaces covalentes ser especificada en términos de longitud de enlace, ángulo de enlace y ángulo torsional.
A. Definiciones de Geometría Molecular
Es la disposición tridimensional de los átomos que constituyen una molécula. Determina muchas de las propiedades de las moléculas, como son la reactividad, polaridad, fase, color, magnetismo, actividad biológica, etc. el principal modelo de geometría molecular es la Teoría de Repulsión de Pares de Electrones de Valencia (TRPEV), empleada internacionalmente por su gran predictibilidad.
A.1. Teorías de la repulsión de los pares de electrones de valencia
También llamada: La teoría de Gillespie-Nyholm, es un modelo usado en química para predecir la forma de las moléculas o iones poliatómicos y está basado en el grado de repulsión electrostática de los pares de electrones de valencia alrededor del átomo. Es un modelo muy simple.
Los pares de electrones de valencia alrededor de un átomo se repelen mutuamente, y por lo tanto, adoptan una disposición espacial que minimiza esta repulsión, determinando la geometría molecular. El número de pares de electrones de valencia alrededor de un átomo, tanto enlazantes como no enlazantes, se denomina número estérico.
Esta teoría ha sido criticada por no ser cuantitativa, y por lo tanto limitarse a la obtención cualitativa de las geometrías moleculares de las moléculas e iones poliatómicos covalentes, a pesar de que es estructuralmente precisa
La geometría predicha es aquella que proporciona a los pares de electrones de la capa de valencia la energía mínima. En realidad, da la casualidad que cuando una distribución de electrones es la adecuada, coincide con una repulsión interelectrónica mínima.
Los pares de electrones pueden ser de dos tipos dependiendo de si forman parte, o no, de un enlace, clasificándose en pares de enlace y pares sueltos, (también denominados pares libres, o pares no enlazantes).
A.2. Aplicación de la teoría de la repulsión de los pares de electrones de la capa de valencia (RPECV) para predecir la geometría molecular sencilla
La teoría RPECV es generalmente comparada y contrastada con la teoría del enlace de valencia, que se ocupa de la forma molecular a través de orbitales que son energéticamente accesibles para formar enlaces. La teoría del enlace de valencia se ocupa de la formación de enlaces sigma y pi. La teoría de los orbitales moleculares es otro modelo para la comprensión de cómo los átomos y los electrones se ensamblan en moléculas e iones poliatómicos mediante la formación de orbitales moleculares. Para predecir la geometría de una molécula necesitamos conocer solamente cuantos grupos de electrones están asociados al átomo central para lo cual debemos escribir la fórmula de Lewis de la molécula. Luego simplemente nos preguntamos como los grupos de electrones se distribuirán espacialmente de modo que la repulsión entre ellos sea mínima.
Reglas para la predicción de la geometría molecular:
-
Las repulsiones ejercidas por los pares de enlace disminuyen al aumentar la electronegatividad de los átomos periféricos. Por ejemplo, si se comparan el NH3 con el NF3, moléculas con el átomo central pertenecientes al mismo grupo, y misma geometría, (piramidal), los ángulos de enlace son, respectivamente 106.6º y 102.2º. Téngase en cuenta que el flúor presenta una electronegatividad de 3,98, en la escala de Pauling y el hidrógeno de sólo 2,20, frente al nitrógeno con 3.
-
La formación de enlaces múltiples (dobles, triples...) no afecta a la estereometría de la molécula, la cual está determinada fundamentalmente por los enlaces \sigma y los pares de electrones libres.
-
La repulsión entre pares de electrones no enlazantes de átomos con capas llenas es mayor que la repulsión entre pares de electrones no enlazantes pertenecientes a átomos con capas de valencia incompleta, como se puede observar en la progresiva disminución de los ángulos en la secuencia de moléculas H2S, H2Se, H2Te, H2O.
-
Cuando el átomo central presenta la capa de valencia incompleta, y uno o más orbitales libres vacíos, existe una tendencia a que los pares de electrones libres de los átomos periféricos se transfieran al primero, como ocurre en el BF3. Los pares de electrones libres que rodean a los átomos de flúor pueden cederse al orbital pz vacío del boro.
-
Cuando hay 5 o 7 pares de electrones las posiciones no son completamente equivalentes. Por ejemplo, en una molécula con geometría de bipirámide trigonal (5 pares), como es el caso del PF5, se pueden distinguir posiciones axiales y posiciones ecuatoriales.
Hay grupos de compuestos donde fallan las predicciones de la TREPEV.
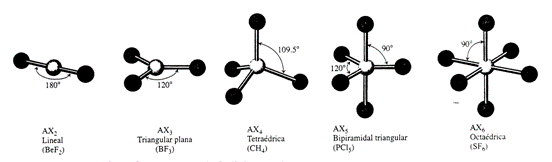
A.3. Diferentes tipos de geometrías moleculares
Existen diferentes tipos de geometría molecular:
Geometría molecular angular: (también llamada en forma de V) describe la disposición de los electrones en el espacio en torno a aquellas moléculas de tipo AX2E1 o AX2E2, según la VSEPR, es decir, aquellas moléculas con dos pares de electrones enlazantes y uno o dos pares no enlazantes. Debido a la existencia de numerosas moléculas con una de estas dos estructuras electrónicas, este tipo de geometría es predominante.
Geometría molecular bipirámide pentagonal: es un tipo de geometría molecular con un átomo central unido mediante enlaces covalentes a siete ligando situados en las esquinas o vértices de una bipirámide pentagonal. Una bipirámide pentagonal perfecta pertenece al grupo puntual molecular D5h. es un caso en el que todos los ángulos de enlace alrededor del átomo central no son idénticos.
Geometría molecular bipirámide trigonal: describe la disposición de seis átomos, cinco de los cuales se ubican en torno al átomo restante, formando una bipirámide triangular. Se trata de uno de los pocos casos en los que los ángulos de enlace que rodean a un átomo no son idénticos, lo cual se debe simplemente a que no existe una disposición geométrica posible con cinco ángulos enlazantes iguales en tres dimensiones.
Geometría molecular cuadrada plana: describe la estereoquímica (disposición espacial de los átomos) que adoptan ciertos compuestos químicos. Como el propio nombre sugiere, las moléculas que poseen esta geometría tienen sus átomos colocados en las esquinas de un cuadrado que están en el mismo plano del átomo central.
Geometría molecular de balancín: describe la disposición de cuatro átomos en torno a un átomo central con un par de electrones no enlazantes. La presencia de este par de electrones evita la existencia de una geometría molecular bipiramidal trigonal, ya que la repulsión originada altera los ángulos de enlace de los átomos cercanos, los cuales se disponen formando una figura parecida a la de un balancín.
Geometría molecular en forma de T: describe la estructura adoptada por algunos van a tomar no trigonales piramidales]]. De acuerdo con la teoría RPECV la geometría en forma de T se da en moléculas de tipo AX3E2 con tres ligandos y dos pares de electrones no enlazantes sobre un átomo central.
Geometría molecular lineal: describe la disposición de distintos átomos con enlaces de 180º. Es la geometría más sencilla descrita por la VSEPR. Las moléculas orgánicas lineales, como el acetileno, suelen presentar hibridación de tipo SP en los átomos de carbono.
Geometría molecular octaédrica: a la forma de los compuestos en los que seis ligandos (átomos, moléculas o iones) se disponen alrededor de un átomo o ion central, definiendo los vértices de un octaedro. Se trata de una estructura muy común, y que es muy estudiada por su importancia en la química de coordinación de los metales de transición. A partir de ella se derivan, por deformación continua, otras geometrías moleculares importantes, como son el octaedro elongado, el octaedro achatado, la pirámide de base cuadrada y el cuadrado plano. Indirectamente, también está relacionada con la geometría molecular tetraédrica.
Geometría molecular piramidal cuadrada: describe la forma o geometría molecular de ciertos compuestos de fórmula química ML5, donde M es un átomo central y L es un ligando. Si los átomos del ligando estuviesen conectados, la forma resultante sería la de una pirámide de base cuadrada.
Geometría molecular piramidal pentagonal: describe la geometría molecular o forma de ciertos compuestos químicos en los que seis átomos o grupos de átomos o ligandos se organizan alrededor de un átomo central, en los vértices de una pirámide pentagonal. Es una de los pocos casos de geometría molecular con ángulos de enlace desiguales.
Geometría molecular piramidal trigonal: es un tipo de geometría molecular con un átomo en el vértice superior y tres átomos en las esquinas de un triángulo, en un plano inferior. Cuando los tres átomos en las esquinas son iguales, la molécula pertenece al grupo puntual C3v.
Geometría molecular tetraédrica: es un tipo de geometría molecular en la que un átomo central se encuentra en el centro enlazado químicamente con cuatro sustituyentes que se encuentran en las esquinas de un tetraedro.
Geometría molecular trigonal plana: es un tipo de geometría molecular con un átomo en el centro y tres átomos en las esquinas de un triángulo, llamados átomos periféricos, todo ellos en el mismo plano.1 En una especie trigonal plana ideal, los tres ligandos son idénticos y todos los ángulos de enlace son de 120°. Estas especies pertenecen al grupo puntual D3h.













B. Tipos de sustancias y sus propiedades
B.1 Metales
Son aquellas que presentan un solo elemento, que forman grandes redes metálicas, donde los electrones de la capa de valencia están deslocalizados moviéndose por todo la sustancia, de esta forma, una nube de electrones recubre la sustancia y le da ese característico brillo metálico. Algunas de estas sustancias son el hierro, el sodio y el potasio.
Las propiedades de estas sustancias son: Sólidos, dureza variada. Puntos de fusión y ebullición también muy variados, insolubles en agua y característico brillo metálico.
Las propiedades de las sustancias metálicas difieren mucho de unas a otras, pero vamos a hablar en general de todas ellas:
-
Densidad: El empaquetamiento compacto de los iones en la red cristalina metálica hace que las densidades de los metales sean altas en general, aunque hay mucha diversidad y excepciones, por ejemplo, los metales alcalinos y el plomo son muy blandos, mientras que el osmio y el platino son muy duros. Todos son sólidos excepto el Mercurio, el Cesio y el Francio que son líquidos.
-
Puntos de fusión y ebullición: En general el enlace metálico mantiene los iones fuertemente unidos dado que la mayoría poseen puntos de fusión y de ebullición muy altos, aunque hay grandes variaciones, desde el cesio, (29ºC), hasta el platino que es casi infusible.Los puntos de fusión y ebullición dependen en gran medida de dos factores:
Del tamaño: A medida que el tamaño del ion es mayor, el punto de ebullición disminuye.
Del número de electrones cedidos por cada átomo: A medida que el número de electrones cedidos por cada átomo sea mayor, el punto de fusión será más alto.
-
Conductividad eléctrica y térmica: Son buenos conductores eléctricos, ya que los electrones de la nube electrónica se pueden mover con total libertad. Por la misma razón, si los metales se calientan, los electrones adquieren mayor energía cinética que se va trasladando por todo el metal.
-
Propiedades mecánicas: Son dúctiles (se pueden hacer hilos por estiramiento) y maleables (se pueden laminar) debido a la naturaleza de las fuerzas que mantienen unido al sólido, es decir, que siempre que la separación entre los cationes no sea muy grande, la nube electrónica los mantendrá unidos).
B.2 Compuestos Iónicos
Un compuesto iónico es un compuesto químico formado por dos sustancias con una diferencia significativa en sus electronegatividades. Se forma preferentemente cuando metales de los grupos I A y II A se unen con los no metales de los grupos VI A y VII A.
De forma general, las propiedades de los compuestos iónicos son:
-
Sólidos a temperatura ambiente: Las fuerzas que mantienen unidos los iones son fuertes, y por este motivo a temperatura ambiente el compuesto se halla en estado sólido.
-
Forman redes cristalinas altamente ordenadas: Los aniones y cationes tienen posiciones definidas en el espacio, en función del tipo de red cristalina.
-
Puntos de fusión y ebullición elevados: Debido a que, como hemos dicho, las fuerzas electrostáticas que mantienen unidos los iones son fuertes, es costoso separarlos. Por este motivo, hay que aportar elevadas temperaturas para fundirlos y para evaporarlos.
-
Elevada dureza: También se debe a la fortaleza del enlace, ya que para rayar la superficie del compuesto hay que romper enlaces de los iones superficiales. Sin embargo, podrán ser rayados por compuestos de mayor dureza, como por ejemplo el diamante (el compuesto de mayor dureza, con un 10 en la escala de Mohs).
-
Fragilidad: A pesar de su dureza, son frágiles frente a los golpes. ¿Por qué? Porque un impacto puede hacer resbalar unas capas sobre otras y que, de pronto, se vean enfrentados entre sí iones del mismo signo. La repulsión electrostática entre iones del mismo signo fragmenta el cristal.
-
No conductores de la corriente en estado sólido: En estado sólido los iones están colocados en posiciones fijas de la red y no presentan movilidad alguna. La falta de movilidad eléctrica hace que no sean conductores.
-
Conductores de la corriente eléctrica en estado fundido o disuelto: Puesto que en estado fundido o disuelto los iones ya sí presentan movilidad, a diferencia de lo que ocurre en estado sólido, en estos estados pueden conducir la corriente.
-
Insolubles en disolventes apolares.
-
Solubles en disolventes polares: Son solubles en disolventes polares como el amoníaco líquido o el agua, pues las moléculas de agua son capaces de rodear los iones y atraerlos electrostáticamente hasta separarlos de la red iónica, fenómeno que se conoce como solvatación. Recordemos que la molécula de agua es un dipolo. Cuanto más estable sea la red, es decir, mayor sea su energía reticular, más difícil será disolverlo porque ser requerirá mayor energía.
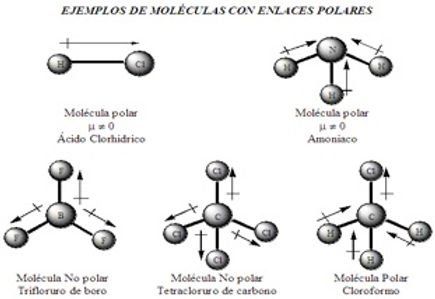
B.3 Compuestos moleculares polares y no polares
Las moléculas polares y no polares son tipos de uniones covalentes en las que dos o más átomos comparten electrones hasta tener ambos ocho en su último orbital.
-
Moléculas Polares: Los enlaces formados por átomos distintos con grandes diferencias de electronegatividad, forman moléculas polares. La molécula es eléctricamente neutra en su conjunto por tener igual de partículas positivas y negativas, pero no existe simetría en la distribución de la electricidad.
Aquellas moléculas cuyos centros de cargas positiva no coinciden con la carga negativas, se denomina moléculas polares, llamándose polar al enlace en el cual un par de electrones de la configuración electrónica externa no está igualmente compartido por los dos átomos.
De este modo, tanto los enlaces iónicos, como los enlaces covalentes pueden formar moléculas polares.
-
Moléculas no Polares: Cuando se forman en un enlace covalente entre átomos iguales, la molécula es neutra es decir, tiene carga eléctrica cero; por ejemplo: H2, O2, Cl2.
En este tipo de enlace no hay cambio en el número de oxidación de los átomos debido a que sus electrones compartidos son equidistantes.
Los enlaces covalentes en los cuales los electrones se comparten por igual se les llama enlaces covalentes no polares.
En estos enlaces covalentes entre átomos iguales sus elementos quedan equidistantes y su molécula es no polar.
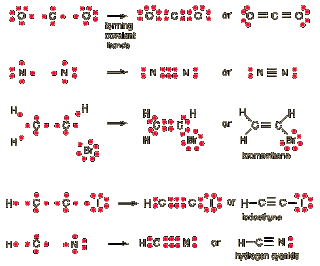
B.4 Enlaces Covalentes
Un enlace covalente entre dos átomos o grupos de átomos se produce cuando estos átomos se unen, para alcanzar el octeto estable, comparten electrones del último nivel. La diferencia de electronegatividades entre los átomos no es lo suficientemente grande como para que se produzca una unión de tipo iónica, en cambio, solo es posible la compartición de electrones con el fin de alcanzar la mayor estabilidad posible; para que un enlace covalente se genere es necesario que el delta de electronegatividad sea menor a 1,7.
De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se producen entre átomos de un mismo no metal y entre distintos no metales. Cuando distintos átomos de no metales se unen, a pesar de que ocurra el compartimento electrónico, uno de ellos resultara más electronegativo que el otro por lo que tendrá tendencia a atraer los electrones hacia su núcleo; esto genera un dipolo eléctrico (o molécula polar) como es el caso del agua. Estas polaridades permiten que las moléculas del mismo compuesto se atraigan entre si por fuerzas electrostáticas relativamente débiles, pero lo suficientemente fuertes para, en la mayoría de los casos, crear un estado de agregación líquido a la sustancia.
Por contrario, cuando átomos de un mismo elemento no metálico se unen covalentemente, su delta de electronegatividad es cero, no se crean dipolos. Ahora, las moléculas entre si poseen prácticamente una atracción nula lo que explica que moléculas diatomicas como el Hidrógeno, Nitrógeno o Flúor se encuentren en estado gaseoso. Sin embargo existe una leve atracción: En un átomo de una molécula, en algún momento dado, un electrón orbitando puede generar un exceso de carga negativa momentáneo e ínfimo en un punto específico del espacio, por los movimientos aleatorios y rápidos de estas partículas, la densidad negativa creada es rápidamente equiparada con otro electrón que sufra la misma situación; sin embargo, estas creaciones instantáneas y cortas de polaridad provocan una muy leve atracción entre las moléculas no polares.
El enlace covalente se presenta cuando dos átomos comparten electrones para estabilizar la unión.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro; en el enlace covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos pueden compartirse uno, dos o tres pares de electrones, lo cual dará lugar a la formación de un enlace simple, doble o triple respectivamente. En la estructura de Lewis, estos enlaces pueden representarse por una pequeña línea entre los átomos.
Existen dos tipos de sustancias covalentes:
-
Sustancias covalentes moleculares: los enlaces covalentes forman moléculas que tienen las siguientes propiedades:
-
Temperaturas de fusión y ebullición bajas.
-
En condiciones normales de presión y temperatura (25 °C aprox.) pueden ser sólidos, líquidos o gaseosos
-
Son blandos en estado sólido.
-
Son aislantes de corriente eléctrica y calor.
-
Solubilidad: las moléculas polares son solubles en disolventes polares y las apolares son solubles en disolventes apolares (semejante disuelve a semejante).
-
Redes o sustancias covalentes reticulares: Además las sustancias covalentes forman redes cristalinas, semejantes a los compuestos iónicos, que tienen estas propiedades:
-
Elevadas temperaturas de fusión y ebullición.
-
Son sólidos.
-
Son sustancias muy duras.
-
Son aislantes (excepto el grafito).
-
Son insolubles.



Compuesto Ionico

C- Determinación de la naturaleza metálica, iónica, polar o no polar de compuestos en función de los tipos de enlaces y la geometría molecular.
D- Fuerza de interaccion molecular
En principio se debe distinguir qué es un enlace químico, siendo éstas las fuerzas que mantienen a los átomos unidos formando las moléculas. Y que existen dos tipos de enlaces químicos, los enlaces covalentes (en donde los átomos comparten dos electrones) y las interacciones débiles no covalentes (interacciones débiles entre iones, moléculas y entre partes de las moléculas).
La diferencia entre un enlace covalente e interacciones débiles no covalentes es que los enlaces covalentes son los responsables de las estructuras primarias, definen la composición e identidad de cada biopolímero y las "configuraciones" que adopta cada grupo molecular, mientras que las interacciones débiles no covalentes son las responsables de la complejidad de las conformaciones que caracterizan la arquitectura molecular de las macromoléculas biológicas y los complejos supraestructurales, es decir, las interacciones intramoleculares (átomos o grupos moleculares dentro de las macromoléculas) e intermoleculares, por lo que son fundamentales para las funciones biológicas,1 pero puede ser mayor la molécula.
Las interacciones débiles no covalentes se les llama "débiles" porque representan la energía que mantienen unidas a las especies supramoleculares y que son considerablemente más débiles que los enlaces covalentes. Las interacciones no covalentes fundamentales son:
· El enlace de hidrógeno (antiguamente conocido como enlace por puente de hidrógeno)
· Las fuerzas de Van der Waals, que podemos clasificar a su vez en:
· dipolo - dipolo.
· dipolo - dipolo inducido.
· Fuerzas de dispersión de London.
D.1 Fuerzas de dispersión de London
Las fuerzas de dispersión de London son un tipo de fuerza intermolecular, denominadas así por el físico alemán Fritz London, quien las investigó en 1930. Surgen entre moleculares polares, en las que pueden aparecer dipolos instantáneos. Son más intensas cuanto mayor es la molécula, ya que los dipolos se pueden producir con más facilidad.
Dipolo-dipolo: consiste en la atracción electrostática entre el extremo positivo de una molécula polar y el negativo de otra. El enlace de hidrógeno es un tipo especial de interacción dipolo-dipolo. Sólo son eficaces a distancias muy cortas; además son fuerzas más débiles que en el caso ion-ion porque q+ y q- representan cargas parciales. Así como las moléculas polares presentan algún tipo de fuerzas intermoleculares como las ya mencionadas, también las sustancia conformadas por moléculas no polares y los átomos que constituyen los gases nobles experimentan atracciones muy débiles llamadas fuerzas de london.
La intensidad de la fuerza de dispersión depende de cierto número de factores. Sin embargo, dar un enfoque cualitativo y predictivo debe considerar que las fuerzas de dispersión se relacionan con el número de electrones que se encuentren en el átomo o en la molécula.
D.2 Dipolo-Dipolo
La interacción dipolo-dipolo consiste en la atracción electrostática entre el extremo positivo de una molécula polar y el negativo de otra. El enlace de hidrógeno es un tipo especial de interacción dipolo-dipolo.
Interacción entre los dipolos eléctricos de las moléculas de cloruro de hidrógeno.
Las fuerzas electrostáticas entre dos iones disminuyen de acuerdo con un factor 1/d2 a medida que aumenta su separación d. En cambio, las fuerzas dipolo dipolo varían según 1/d3 (d elevado a la tercera potencia) y sólo son eficaces a distancias muy cortas; además son fuerzas más débiles que en el caso ion-ion porque q+ y q- representan cargas parciales. Las energías promedio de las interacciones dipolo dipolo son aproximadamente 4 kJ por mol, en contraste con los valores promedio para energías características de tipo iónico y deenlace covalente (~400 kJ por mol).
Estas son ligeramente direccionales, es decir, al elevarse la temperatura, el movimiento transicional, rotacional y vibracional de las moléculas aumenta y produce orientación más aleatoria entre ellas. En consecuencia, la fuerza de las interacciones dipolo-dipolo disminuye al aumentar la temperatura
D.3 Puente de hidrógeno
Un enlace por puente de hidrógeno o enlace de hidrógeno es la fuerza atractiva entre un átomo electronegativo y un átomo de hidrógeno unido covalentemente a otro átomo electronegativo. Resulta de la formación de una fuerza dipolo-dipolo con un átomo de hidrógeno unido a un átomo de nitrógeno, oxígeno o flúor (de ahí el nombre de "enlace de hidrógeno", que no debe confundirse con un enlace covalente a átomos de hidrógeno. Tampoco debería confundirse con el enlace llamado puente de hidrógeno, característico de estructuras como los boranos, que constan de un enlace de tres centros con dos electrones). La energía de un enlace de hidrógeno (típicamente de 5 a 30 kJ/mol) es comparable a la de los enlaces covalentes débiles (155 kJ/mol), y un enlace covalente típico es sólo 20 veces más fuerte que un enlace de hidrógeno intermolecular. Estos enlaces pueden ocurrir entre moléculas (intermolecularidad), o entre diferentes partes de una misma molécula (intramolecularidad).2 El enlace de hidrógeno es una fuerza electrostática dipolo-dipolo fija muy fuerte, pero más débil que el enlace covalente o el enlace iónico. El enlace de hidrógeno está en algún lugar intermedio entre unenlace covalente y una fuerza de van der Waals. Este tipo de enlace ocurre tanto en moléculas inorgánicas tales como elagua, y en moléculas orgánicas como el ADN.
D.4 Ion-Dipolo
En una atracción del carácter ion-dipolo, los iones de una sustancia pueden interactuar con los polos de las moléculas covalentes polares. Así, el polo negativo de una molécula atrae al ion positivo y el polo positivo interactúa con el ion negativo: las partes de cada molécula se unen por fuerzas de atracción de cargas opuestas. Ejemplo de este tipo de interacción se produce en la solvatación de una solución acuosa de cloruro de sodio (NaCl). También se produce en la solvatación acuosa de H2O y como también hay muchas,como por ejemplo el cobre entre otros metales.
Recordemos que la electronegatividad es la fuerza de atracción ejercida sobre los electrones de un enlace. Ella es considerada como una propiedad periódica, o sea que, a medida que el número atómico aumenta, asume valor creciente o decreciente en cada período de la tabla periódica de elementos.
Los átomos ejercen una fuerza de atracción sobre los electrones de un enlace y esa fuerza se relaciona con el radio atómico, porque cuanto menor el tamaño del átomo, mayor será la fuerza de atracción.
La manera de saber sobre la electronegatividad de un átomo, es observando su posición en la Tabla Periódica, la electronegatividad crece desde abajo hacia arriba y de izquierda a derecha.
En la interacción ión-dipolo, el catión sufre atracción electrostática por el dipolo negativo, mientras que el anión es atraído por la fuerza electrostática hacia el dipolo positivo.
El clásico ejemplo de la interacción ión-dipolo es la solución acuosa de cloruro de sodio (NaCl). En esta sal, el enlace es iónico. Entonces cuando se disuelve en agua, se disocia completamente en cationes Na+ y aniones Cl-.
En la molécula de agua, el átomo de oxígeno tiene mayor electronegatividad que el de hidrógeno, por lo tanto existe un dipolo negativo en torno al oxígeno, y un dipolo positivo en torno al átomo de hidrógeno.
Entonces los cationes Na+ sufren atracción electrostática por el dipolo negativo del átomo de oxígeno, y los aniones Cl-, sufren fuerza de atracción electrostática por el dipolo positivo del hidrógeno.
Para poder intervenir en interacciones ión-dipolo, las moléculas polares tienen que tener momento dipolar distinto de cero.
En moléculas tales como el CO2 o el CCl4 , a pesar de las diferencias de electronegatividad entre los átomos de oxígeno y carbono, para el primer caso, y de carbono y cloro, para el segundo caso, el momento dipolar es cero.
Esto sucede porque son moléculas simétricas, y los vectores de los momentos dipolares parciales de cada enlace covalente se anulan entre sí.
De todos modos, moléculas con momento dipolar igual a cero, pueden tener dipolos transitorios si son sometidas a un campo eléctrico. En este caso se observarán interacciones ión-dipolo inducido. La magnitud de esta interacción depende de la capacidad de la molécula para que se le induzca un dipolo. Esta característica se denomina polarizabilidad.
D.5 Ion-Ion
Un ion es un átomo o molécula en la que el número total de electrones no es igual al número total de protones, dando el átomo o molécula de una carga eléctrica neta positiva o negativa.
Los iones se pueden crear, por medios químicos o físicos, ya sea, a través de la ionización. En términos químicos, si un átomo neutro pierde uno o más electrones, tiene una carga neta positiva y se conoce como un catión. Si un átomo gana electrones, tiene una carga neta negativa y se conoce como un anión. Un ion que consiste en un solo átomo es un ion atómica o monoatómico; si se trata de dos o más átomos, es un ion molecular o poliatómico. Debido a sus cargas eléctricas, cationes y aniones se atraen entre sí y forman fácilmente compuestos iónicos, tales como sales.
En el caso de ionización física de un medio, tal como un gas, lo que se conoce como "pares de iones" se crean por el impacto de iones, y cada par se compone de un electrón libre y un ion positivo.




¿Qué es un enlace Químico?
-
Un enlace químico es el proceso químico responsable de las interacciones entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos diatómicos y poli atómicos. Es uno de los conceptos químicos más difícil de explicar; es por eso que se aborda a través de diversas teorías.
¿Cuál es el concepto de Enlace Químico?
-
Los enlaces químicos (determinados por la manera en la cual se comportan los electrones), dentro de la física, son fuerzas que permiten la unión de los átomos, para constituir moléculas, que poseen mayor estabilidad; dos átomos ligados a través de alguno de estos enlaces, conforman una molécula. La mayoría de los átomos logra ser considerado estable, cuando posee ocho electrones en su último nivel energético (regla del octeto).
B. Tipos de enlaces químicos
¿Cuáles son los tipos de enlaces Químicos?
R= Los tipos de enlaces químicos son:
-
Iónico
-
Enlace covalente
-
Enlace metálico
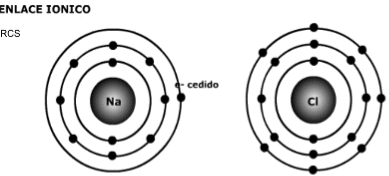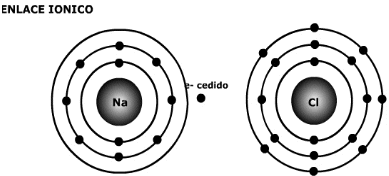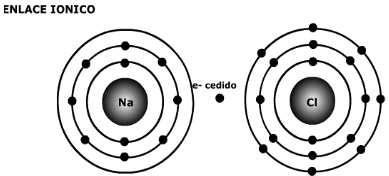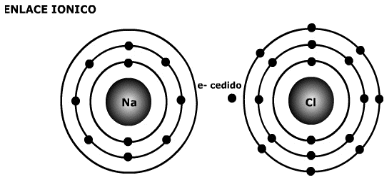
B.1 Enlace Iónico
Enlace Iónico
-
En Química, un enlace iónico o electrovalente es la unión de átomos que resulta de la presencia de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto químico simple, aquí no se fusionan; sino que uno da y otro recibe. Para que un enlace iónico se genere es necesario que la diferencia (delta) de electronegatividades sea más que 1,7.
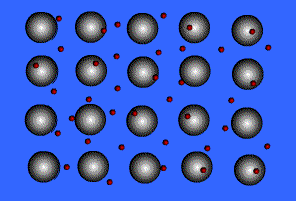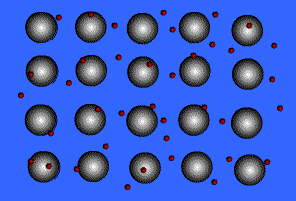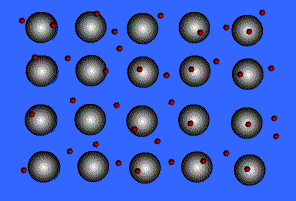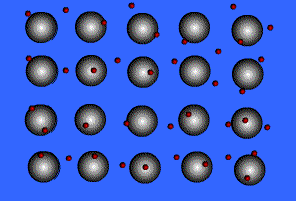
B.1.1 Ejemplos de compuestos iónicos
Compuesto de Iónico
-
Los compuestos iónicos estado sólido forman estructuras reticulares cristalinas. Los dos factores principales que determinan la forma de la red cristalina son las cargas relativas de los iones y sus tamaños relativos. Existen algunas estructuras que son adoptadas por varios compuestos, por ejemplo, la estructura cristalina del cloruro de sodio también es adoptada por muchos haluros alcalinos y óxidos binarios, tales como MgO.
Clasificación de los iones
Los iones se clasifican en dos tipos:
a) Anión: Es un ion con carga eléctrica negativa, lo que significa que los átomos que lo conforman tienen un exceso de electrones. Comúnmente los aniones están formados por no metales, aunque hay ciertos aniones formados por metales y no metales. Los aniones más habituales son (el número entre paréntesis indica la carga):
-
F- fluoruro.
-
Cl- cloruro.
-
Br- bromuro.
-
I- yoduro.
-
S 2- sulfuro.
-
SO42- sulfato.
-
entre otros.
b) Catión: es un ion con carga eléctrica positiva. Los más comunes se forman a partir de metales, pero hay ciertos cationes formados con no metales.
-
Na+ sodio.
-
K+ potasio.
-
Ca2+ calcio.
-
Ba2+ bario.
-
Mg2+ magnesio.
-
Al3+ aluminio.
B.2 Enlace Covalente Polar
Enlace de Covalente Polar?
-
Lewis expuso la teoría de que todos los elementos tienen tendencia a conseguir configuración electrónica de gas noble 8 electrones en la última capa. Elementos situados a la derecha de la tabla periódica (no metales) consiguen dicha configuración por captura de electrones; elementos situados a la izquierda y en el centro de la tabla metales, la consiguen por pérdida de electrones.
B.2.1. Ejemplos de enlaces covalentes polares
Ejemplo de Covalentes polares
-
Por ejemplo, en BCl3, el átomo de boro tiene seis electrones en la última capa, y en SF6, el átomo de azufre consigue hasta doce electrones. Esto hace que actualmente se piense que lo característico del enlace covalente es la formación de pares electrónicos compartidos, independientemente de su número.
B.3 Enlace Covalente No Polar
Enlace covalente no polar
-
Cuando el enlace lo forman dos átomos del mismo elemento, la diferencia de electronegatividad es cero, entonces se forma un enlace covalente no polar. El enlace covalente no polar se presenta entre átomos del mismo elemento o entre átomos con muy poca diferencia de electronegatividad. Un ejemplo es la molécula de hidrógeno, la cual está formada por dos átomos del mismo elemento, por lo que su diferencia es cero. Otro ejemplo, pero con átomos diferentes, es el metano. La electronegatividad del carbono es 2.5 y la del hidrógeno es 2.1; la diferencia entre ellos es de 0.4 (menor de 0.5), por lo que el enlace se considera no polar. Además el metano es una molécula muy simétrica, por lo que las pequeñas diferencias de electronegatividad en sus cuatro enlaces se anulan entre sí.
B.3.1 Ejemplo de enlaces covalentes no polares
Ejemplo de Covalente No Polar?
-
ion o dipolo permanente producen en una molécula no polar una separación de cargas por el fenómeno de inducción electrostática y fuerzas de dispersión aparecen en tres moléculas no polares.
B.4 Enlaces Electro Covalentes
Un enlace covalente entre dos átomos o grupos de átomos se produce cuando estos átomos se unen, para alcanzar el octeto estable, comparten electrones del último nivel.1 La diferencia de electronegatividades entre los átomos no es lo suficientemente grande como para que se produzca una unión de tipo iónica, en cambio, solo es posible la compartición de electrones con el fin de alcanzar la mayor estabilidad posible; para que un enlace covalente se genere es necesario que el delta de electronegatividad sea menor a 1,7.
El enlace covalente se presenta cuando dos átomos comparten electrones para estabilizar la unión.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro; en el enlace covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos pueden compartirse uno, dos o tres pares de electrones, lo cual dará lugar a la formación de un enlace simple, doble o triple respectivamente. En la estructura de Lewis, estos enlaces pueden representarse por una pequeña línea entre los átomos.
B.4.1 Ejemplos de compuestos electro covalentes
Sustancias covalentes moleculares: los enlaces covalentes forman moléculas que tienen las siguientes propiedades:
-
Temperaturas de fusión y ebullición bajas.
-
En condiciones normales de presión y temperatura (25 °C aprox.) pueden ser sólidos, líquidos o gaseosos
-
Son blandos en estado sólido.
-
Son aislantes de corriente eléctrica y calor.
-
Solubilidad: las moléculas polares son solubles en disolventes polares y las apolares son solubles en disolventes apolares (semejante disuelve a semejante).
Redes o sustancias covalentes reticulares: Además las sustancias covalentes forman redes cristalinas, semejantes a los compuestos iónicos, que tienen estas propiedades:
-
Elevadas temperaturas de fusión y ebullición.
-
Son sólidos.
-
Son sustancias muy duras.
-
Son aislantes (excepto el grafito).
-
Son insolubles.
B.5 Enlaces Metálicos
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí.
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo.
En este tipo de estructura cada átomo metálico está dividido por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales. Este enlace sólo puede estar en sustancias en estado sólido.1
Los metales poseen algunas propiedades características que los diferencian de los demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y tienen un punto de fusión alto.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente presentan brillo y son maleables. Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen. La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones deslocalizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.
B.5.1 Ejemplo de compuesto metálico
Oxido de aluminio Al2O3 Oxido de Calcio CaO Oxido Auroso Au2O
Hidruro de Litio LiH Hidruro de Cadmio CdH2(pilas) Hidróxido de Aluminio Al(OH)3
Hidróxido de Cinc Zn(OH)2 Hidruro de radio RaH2
B.6 Enlaces Moleculares
Un enlace molecular, o covalente, se forma cuando los átomos se unen intercambiando pares de electrones. Este intercambio puede ocurrir dátomo a otro, o de un átomo a otro enlace molecular.
Características
Los enlaces moleculares se clasifican como enlaces singulares o múltiples. Las uniones moleculares forman enlaces simples, en el que dos átomos sólo comparten un par de electrones.
B.6.1 Ejemplo de compuesto molecular
A diferencia de los compuestos Iónicos, los compuestos moleculares están formados por unidades moleculares discretas. Por lo regular están formados por elementos no metálicos. Sin embargo una similitud es que muchos de los compuestos moleculares son binarios (formado por 2 elementos).
La nomenclatura es similar, ya que primero se nombra el segundo elemento de la formula agregando el sufijo -uro y después el nombre del primer elemento. Aqui algunos ejemplos:
C. Propiedades de los compuesto de acuerdo al tipo de enlace
Las propiedades físicas de un compuesto dependen principalmente del tipo de enlaces que mantienen unidos a los átomos de una molécula. Éstos puede indicar el tipo de estructura y predecir sus propiedades físicas. A continuación se darán a conocer los tipos de enlaces que influencian las propiedades de los compuestos químicos.
ii. El enlace químico





Enlace Metálico










C.1 Propiedades de compuestos ionicos
De forma general, las propiedades de los compuestos iónicos son:
-
Sólidos a temperatura ambiente. Las fuerzas que mantienen unidos los iones son fuertes, y por este motivo a temperatura ambiente el compuesto se halla en estado sólido.
-
Forman redes cristalinas altamente ordenadas. Los aniones y cationes tienen posiciones definidas en el espacio, en función del tipo de red cristalina.
-
Puntos de fusión y ebullición elevados. Debido a que, como hemos dicho, las fuerzas electrostáticas que mantienen unidos los iones son fuertes, es costoso separarlos. Por este motivo, hay que aportar elevadas temperaturas para fundirlos y para evaporarlos.
-
Elevada dureza. También se debe a la fortaleza del enlace, ya que para rayar la superficie del compuesto hay que romper enlaces de los iones superficiales. Sin embargo, podrán ser rayados por compuestos de mayor dureza, como por ejemplo el diamante (el compuesto de mayor dureza, con un 10 en la escala de Mohs).
-
Fragilidad. A pesar de su dureza, son frágiles frente a los golpes. ¿Por qué? Porque un impacto puede hacer resbalar unas capas sobre otras y que, de pronto, se vean enfrentados entre sí iones del mismo signo. La repulsión electrostática entre iones del mismo signo fragmenta el cristal.
-
No conductores de la corriente en estado sólido. En estado sólido los iones están colocados en posiciones fijas de la red y no presentan movilidad alguna. La falta de movilidad eléctrica hace que no sean conductores.
-
Conductores de la corriente eléctrica en estado fundido o disuelto. Puesto que en estado fundido o disuelto los iones ya sí presentan movilidad, a diferencia de lo que ocurre en estado sólido, en estos estados pueden conducir la corriente.
-
Insolubles en disolventes apolares.
-
Solubles en disolventes polares. Son solubles en disolventes polares como el amoníaco líquido o el agua, pues las moléculas de agua son capaces de rodear los iones y atraerlos electrostáticamente hasta separarlos de la red iónica, fenómeno que se conoce como solvatación. Recordemos que la molécula de agua es un dipolo. Cuanto más estable sea la red, es decir, mayor sea su energía reticular, más difícil será disolverlo porque ser requerirá mayor energía. Por ello, aunque en general digamos que los compuestos iónicos son solubles en agua, algunos de ellos no lo son (por ejemplo, el yoduro de plomo, que en agua precipita tal y como puedes ver aquí).
C.2 Propiedades de los compuestos covalentes polares
-
Características del enlace covalente polar
-
Enlace sencillo o simple: se comparten 2 electrones de la capa de valencia.
-
Enlace doble: se comparten cuatro electrones, en dos pares, de la capa de valencia.
-
Enlace triple: se comparten 6 electrones de la capa de valencia en 3 pares.
-
Enlace cuádruple: es la unión de 8 electrones de la capa de valencia en 4 pares.
-
Enlace quíntuple: es la unión de 10 electrones de la capa de valencia en 5 pares.
-
En general cuando un átomo comparte los dos electrones para uno solo se llama enlace covalente dativo y se suele representar con una flecha (→).
C.3 Propiedades de los compuestos covalentes no polares
Cuando el enlace lo forman dos átomos del mismo elemento, la diferencia de electronegatividad es cero, entonces se forma un enlace covalente no polar. El enlace covalente no polar se presenta entre átomos del mismo elemento o entre átomos con muy poca diferencia de electronegatividad. Un ejemplo es la molécula de hidrógeno, la cual está formada por dos átomos del mismo elemento, por lo que su diferencia es cero. Otro ejemplo, pero con átomos diferentes, es el metano. La electronegatividad del carbono es 2.5 y la del hidrógeno es 2.1; la diferencia entre ellos es de 0.4 (menor de 0.5), por lo que el enlace se considera no polar. Además el metano es una molécula muy simétrica, por lo que las pequeñas diferencias de electronegatividad en sus cuatro enlaces se anulan entre sí. Muchas sustancias mantienen unidas sus moléculas entre sí en el seno líquido o sólido. Esto es debido, además de las condiciones de presión y temperatura, por las fuerzas de Van der Waals. Estas se producen aún en moléculas no polares por el movimiento de los electrones a través de las moléculas; en lapsos sumamente pequeños de tiempo, los electrones de las mismas se "cargan" hacia un extremo de la molécula, produciendo pequeños dipolos y manteniendo las moléculas muy cercanas entre sí.
C.4 Propiedades de los compuestos metálicos
Características:
-
Se da entre átomos metálicos.
-
Los cationes forman una estructura cristalina y los electrones ocupan los intersticios que quedan libres en ellos sin estar fijados en ningún catión concreto (mar de electrones)
-
Los electrones están, pues, bastante libres pero estabilizan la estructura al tener carga contraria a los cationes.
Propiedades:
-
Suelen ser sólidos a temperatura ambiente.
-
Tienen puntos de fusión y ebullición muy variado (aunque suelen ser más bien alto).
-
Las conductividades térmicas y eléctricas son muy elevadas.
-
Presentan brillo metálico.
-
Son muy solubles en estado fundido en otros metales formando aleaciones.
-
Son dúctiles y maleables (no frágiles).
C.5 Propiedades de los compuesto molecular
Los compuestos covalentes moleculares están formados por átomos de elementos no metálicos diferentes unidos por enlaces covalentes. Pueden ser :Sencillo, doble y triple. Cada átomo aporta la mitad de los electrones para llegar a tener 8 electrones en la última capa o 2 electrones como el helio.
Se forman moléculas pequeñas casi independientes unas de otras. Estos compuestos no son muy duros, tienen bajos puntos de fusión y de ebullición, sin conducir corriente eléctrica y tienden a ser insolubles en agua. Su estado físico es variado (gases, a veces líquidos y sólidos). Otro tipo de compuestos covalentes son los sólidos reticulares.
Unos ejemplos de compuesto molecular son:H2, O2, N2, Cl2.
Otros ejemplos de compuesto molecular sería el metano, cuyas unidades básicas son grupos de átomos unidos entre sí. La molécula de metano consta de un átomo de carbono con cuatro átomos de hidrógeno unidos a él. Los enlaces son enlaces covalentes, en los que los electrones son compartidos por los átomos. La forma general de la molécula es un tetraedro, una figura con cuatro caras triangulares idénticas, con un átomo de hidrógeno en cada vértice y el átomo de carbono en el centro.
Los compuestos moleculares consisten en moléculas individuales en las que un número definido de átomos se unen formando una distribución espacial determinada. El número de átomos de una molécula puede variar entre dos (como en el hidrógeno molecular, H2, en el que están unidos dos átomos de hidrógeno), hasta varios miles, como en las moléculas proteínicas (proteínas) que controlan los procesos biológicos, y en los polímeros naturales y sintéticos que se utilizan en los materiales estructurales. Las sustancias con moléculas compuestas por un número pequeño de átomos tienen generalmente puntos de fusión y ebullición bajos ya que las moléculas se pueden separar entre sí muy fácilmente. Las sustancias que son líquidas o gaseosas a temperatura ambiente son compuestos moleculares, como también lo son muchas de las que se funden al calentarlas. Los compuestos moleculares suelen ser blandos y muchos son tan frágiles como los compuestos iónicos porque las moléculas están unidas entre sí en una forma especial y altamente direccional (enlace de hidrógeno). Algunas moléculas se descomponen al calentarlas, y en lugar del líquido o el gas, sólo se obtienen productos de descomposición. Esto ocurre con muchas de las moléculas orgánicas de mayor tamaño.






