
League of Chemistry
apuntes teoricos
ii trimestre
I. Formulación y nomenclatura de los compuestos inorgánicos
A- concepto de formulación y de nomenclatura
Cada compuesto se le solía dar un nombre que generalmente hacía referencia a su procedencia como, por ejemplo, geraniol (presente en los geranios), ácido fórmico (presente en las hormigas), ácido láctico (presente en la leche), etc. Sin embargo debido al enorme número de compuestos del carbono, se vio la necesidad de nombrarlos de una forma sistemática. La Unión Internacional de Química Pura y Aplicada (IUPAC) desarrolló un sistema de formulación y nomenclatura que es el que vamos a seguir en las siguientes páginas. Hemos seguido las recomendaciones de Nomenclatura de Química orgánica de la IUPAC de 1993. Dichas recomendaciones modifican las anteriores de 1979. Los cambios propuestos están relacionados con la nomenclatura de algunos compuestos y consisten básicamente en colocar los numerales que indican la posición del doble o triple enlace o del grupo funcional inmediatamente delante de la terminación del nombre.
La nomenclatura química es el conjunto de reglas que se usan para nombrar a las combinaciones existentes entre los elementos y los compuestos químicos. Al igual que en el caso de la nomenclatura biológica, existe una autoridad internacional encargada de establecer estas reglas. Además de todo lo expuesto tenemos que dejar patente que existen dos sistemas diferentes. Uno es de nomenclatura para compuestos inorgánicos y otro para compuestos orgánicos.
A.1. Historia de la formulación química
En los primeros pasos de la química, gran cantidad de las sustancias que se usaban eran conocidas por los nombres que la alquimia o la historia les había ido otorgando. Esto suponía un problema, porque según los conocimientos en química fueron aumentando se hizo evidente la necesidad de establecer un método para poder nombrar elementos y compuestos químicos que fuese común a todos lo lugares y que diese información sobre cuál era su composición.
El primero en llamar la atención sobre esta necesidad según la IUPAC (International Union for Pure and Applied Chemistry) fue el químico y político francés Guyton de Morveau en 1782, año en que publicó sus recomendaciones esperando que "ese constante método de denominación ayudase a la inteligencia y aliviase la memoria". Este método fue refinado en colaboración con Berthollet, de Fourcroy y Lavoisier, y promovido por el libro publicado por este último Método de la nueva nomenclatura química (enlace a libro).
La fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula. También puede darnos información adicional como la manera en que se unen dichos átomos mediante enlaces químicos e incluso su distribución en el espacio. Para nombrarlas, se emplean las reglas de la nomenclatura química.
A.2. Bases para la Nomenclatura Inorgánica
Nomenclatura sistemática (o estequiométrica): Está basada en nominar a las sustancias mediante la utilización de prefijos con números griegos. Dichos prefijos nos indican la atomicidad que posea la molécula, o lo que es lo mismo, el número de átomos del mismo elemento que se encuentren en la molécula.
Nomenclatura de Stock: En este tipo de nomenclatura se nombran los compuestos finalizándolos con la valencia indicada en números romanos, colocados generalmente como subíndices.
Nomenclatura tradicional: También conocida como nomenclatura clásica, se emplea indicando la valencia del elemento a través de prefijos y sufijos que acompañan al nombre del elemento.Cuando el elemento a tratar sólo posee una valencia, se utiliza el prefijo –ico, pero cuando tiene dos valencia, se utilizan los prefijos –oso ( para la valencia menor) e –ico ( para la mayor). En cambio, cuando el elemento tiene tres o cuatro valencia:
-
Hipo- …-oso
-
…-oso
-
…-ico
-
Per-…-ico
A.2.1. Número de oxidación
El número de oxidación es un número entero que representa el número de electrones que un átomo pone en juego cuando forma un compuesto determinado.
El número de oxidación es positivo si el átomo pierde electrones, o los comparte con un átomo que tenga tendencia a captarlos. Y será negativo cuando el átomo gane electrones, o los comparta con un átomo que tenga tendencia a cederlos.
El número de oxidación se escribe en números romanos (recuérdalo cuando veamos la nomenclatura de Stock): +I, +II, +III, +IV, -I, -II, -III, -IV, etc. Pero en esta página también usaremos caracteres arábigos para referirnos a ellos: +1, +2, +3, +4, -1, -2, -3, -4 etc., lo que nos facilitará los cálculos al tratarlos como números enteros.
En los iones monoatómicos la carga eléctrica coincide con el número de oxidación. Cuando nos refiramos al número de oxidación el signo + o - lo escribiremos a la izquierda del número, como en los números enteros. Por otra parte la carga de los iones, o número de carga, se debe escribir con el signo a la derecha del dígito: Ca2+ ión calcio(2+), CO32- ión carbonato(2-).
A.3. Nomenclatura de iones
Los iones pueden ser atomos individuales (ión monoatómico) o grupo de átomos (iones poliatómicos) que poseen carga eléctrica neta diferente de cero debido a la pérdida o ganancia de electrones.
Cationes
Son iones que poseen carga eléctrica positiva, según el número de átomos se clasifican en:
-
Monoatómicos
-
Poliatómicos
1. Cationes Monoatómicos: Se les aplica el mismo nombre que a los elementos correspondientes precedidos del término ión o catión. Se emplea nomenclatura stock y nomenclatura clásica para referirse a ellos.
2. Cationes Poliatómicos: Se nombran citando los elementos constituyentes, generalmente con nombres comunes y vulgares. En el caso de cationes formados al adicionar un protón (H+) a una molécula neutra, se añade el sufijo ONIO a la raíz del nombre común de la molécula.
A.3.1. Monoatómicos
-
¿Qué es Monoatómico?
En física y química, monoatómico proviene etimológicamente de la combinación de las palabras griegas «mono», «uno» y «atomic», «sin partes» o «irrompible», y significa «un sólo átomo». Es aplicado normalmente a gases. Un gas monoatómico es aquel cuyos átomos no están unidos entre sí.
Bajo condiciones normales de presión y temperatura (CNPT), todos los gases nobles son monoatómicos, además de los vapores metálicos. Para encontrar un gas monoatómico el elemento ha de tener normalmente valencia cero, como para el caso de los gases nobles, o ser un gas diatómico bajo condiciones extremadamente bajas de presión, como es el caso del oxígenoen la parte más alta atmósfera de la Tierra.
También es conocido como estado-m.
-
¿Cuáles son sus propiedades?
Los gases monoatómicos no-ionizados tienden a tener capacidades caloríficas a volumen constante cercanas a 3/2R (siendo R la constante de los gases ideales) siendo exacto en el modelo de gas ideal (análogamente la capacidad a presión constante es 5/2R). Esto es especialmente cierto cuanto más rarificado esté el gas o a más alta temperatura se encuentren. Este resultado es una consecuencia del teorema de equipartición de la energía, siendo los grados de libertad traslacionales los únicos generalmente accesibles y el espacio tridimensional, dicho teorema predice que la capacidad calorífica debería ser 3/2R. Numéricamente las predicciones de la estadística mecánica clásica predicen para un gas monoatómico ideal los siguientes valores:
-
Capacidad calorífica molar bajo presión constante (Cp) es 5/2 R = 20.8 J K-1 mol-1 (4.97 cal K-1 mol-1)
-
Capacidad calorífica molar bajo volumen constante (Cv) es 3/2 R = 12.5 J K-1 mol-1 (2.98 cal K-1 mol-1)
Donde R es la constante universal de los gases ideales.
A.3.2. Poliatómicos
-
¿Que es Poliatómico?
Los Iones Poliatómicos se define como una especie química, ya sea un átomo o una molécula cargada eléctricamente. Esto se debe a que ha ganado o perdido electrones en una reacción química. Los iones cargados negativamente producidos por la ganancia de electrones se conocen como aniones, y los cargados positivamente como consecuencia de la pérdida de electrones, se les conoce como cationes.
-
¿Cuáles son sus propiedades?
-
Un ión poliatómico es un grupo de dos o más átomos que están químicamente unidos y tienen carga positiva o negativa, y que son considerados como una unidad en las reacciones químicas.
-
Los iones poliatómicos más comunes tienen carga negativa. Esto significa que el grupo de átomos ha ganado electrones. Por ejemplo, el ión fosfato, PO43- ha ganado tres electrones extra (además de los que ya tenían los átomos de fósforo y oxígeno).
-
Los electrones son compartidos por todos los átomos del ión poliatómico.
-
El ión poliatómico con carga positiva más común es el amonio NH41+.
-
En la mayoría de los iones poliatómicos, existe un átomo central, alrededor del cual se sitúan los demás átomos.
-
Generalmente son átomos de oxígeno los que rodean el átomo central, y en este caso el ion es llamado oxoanión. Muchos oxoaniones son bases débiles y reaccionan con hidrógeno para formar ácidos o sales ácidas, tal es el caso del ácido sulfúrico H2SO4 y el ácido nítrico HNO3.
-
Los oxoaniones también pueden formar bases fuertes, como KOH (hidróxido de potasio) o soda cáustica NaOH.
A.3.3. Lista de aniones y cationes más comunes
H+
Hidrógeno H -
HidruroHidruroLi+
Litio Litio O -2
Oxido/OxoOxido/OxoNa+
Sodio Sodio OH -
HidróxidoHidróxidoK +
Potasio Potasio Rb +
Rubidio Rubidio F -
FluoruroFluoruro Ag +
Rubidio Rubidio F -
FluoruroFluoruro Ag +
nio Amonio Br -
BromuroBromuroBe +2
Berilio Berilio I -
IoduroIoduroMg +2
Magnesio MagnesioS -2
SulfuroSulfuroCa +2
Calcio Calcio Sr +2
Estroncio EstroncioClO -
Oxoclorato(I)HipoclorosoBa
+2
Bario Bario ClO 2-
Dioxoclorato(III)ClorosoRa +2
Radio Radio ClO 3-
A.4. Reglas de formulación


Formulación
Química
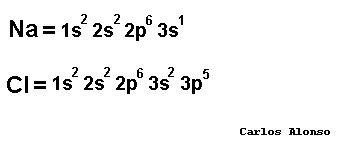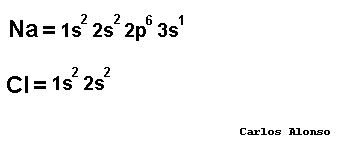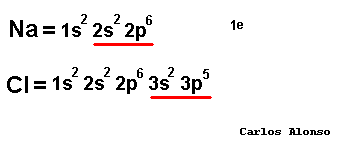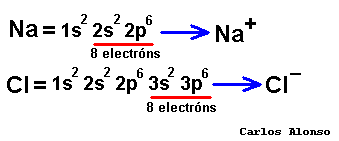


Monoatómico

Poliatómico
Trioxoclorato(V)ClóricoZn +2
Zinc Zinc ClO 4-
Tetraoxoclorato(VII) PerclóricoCd
+2
Cadmio Cadmio BrO -
Oxobromato(I)HipobromosoCu +
Cobre(I) Cuproso BrO 2-
Dioxobromato(III)BromosoCu +2
Cobre(II) Cúprico BrO 3-
Trioxobromato(V) BrómicoHg +
Mercurio(I) MercuriosoBrO 4-
Tetraoxobromato(VII) P
Mercurio(II) MercúricoIO -
Oxoiodato(I)Hipoiodoso Al +3
Aluminio Aluminio IO 2-
Dioxiodato(III)Iodoso Au +
Oro(I) Auroso IO 3-
Trioxoiodato(V)Iódico Au +3
Oro(III) Aurico IO 4-
Tetraoxoiodato(VII) PeriódicoFe +2
Hierro(II) Ferroso Fe +3
Hierro(III) Férrico SO 3-2
Trioxosulfato(IV)SulfitoCo +2
Cobalto(II) CobaltosoSO 4-2
Tetraoxosulfato(VI) SulfatoCo +3
Ni +2
Níquel(II) NiquelosoNO 2-
Dioxonitrato(III) Nitrito Ni +3
Níquel(III) Niquélico NO 3-
Trioxonitrato(V)NitratoSn +2
Estaño(II) Estannoso
Sn +4
Estaño(IV) EstánnicoPO 3-3
Trioxofosfato(III)OrtofosfitoPb +2
Plomo(II) PlumbosoPO 4-3
Tetraoxofosfato(V) OrtofosfatoPb +4
Plomo(IV) Plúmbico Pt +2
Platino(II) Platinoso CO 3-2
Trioxocarbonato(IV) CarbonatoPt+4
Platino(IV) Platínico HCO 3-
Trioxohidrógenocarbonato(IV) BicarbonatoIr +2
Iridio(II) Iridioso Ir +4
Iridio(IV) Irídico CrO 4-2
Tetraoxocromato(VI) CromatoMn +2
Manganeso(II)ManganosoMnO 4-
Tetraoxomanganato(VII) PermanganatoMn +4
Manganeso(IV)Mangánico
Cobalto(III) Cobáltico
-
Al tratarse de una estructura ramificada, debemos elegir primero cuál será nuestra cadena principal. Esta será la más larga, que contenga a su vez el o los grupos funcionales principales; en dicha cadena, los carbonos se numerarán comenzando por el grupo funcional terminal.
-
La cadena principal es de 8 átomos de carbono; ello nos indica que elegiremos el prefijo oct-. En cuanto a los grupos funcionales, el principal es el ácido, sobre el carbono 1. Por ello, el nombre del compuesto comenzará con “ácido” y terminará con el sufijo “-oico”. También hay dos grupos alcohólicos, sobre los carbonos 5 y 6. Para designarlos, al tener ya fijada la terminación -oico, utilizaremos el prefijo “hidroxi-“, que sustituye al sufijo “-ol”.
-
Por otra parte, los carbonos 2 y 7 soportan ramificaciones hidrocarbonadas, que se nombran uniendo el prefijo que indica el nº de átomos de carbono y la terminación “-il”. -CH3 Metil -CH2 -CH3 Etil
-
Teniendo en cuenta todo lo anterior, el compuesto en cuestión será: ácido 2-etil-7-metil-5,6-dihidroxioctanoico
B. Sistemas de nomenclatura según la IUPAC
La Nomenclatura IUPAC es un sistema de nomenclatura de compuestos químicos y de descripción de la ciencia y de la química en general.
Está desarrollado y actualizado bajo el patrocinio de la Unión Internacional de Química Pura y Aplicada.
Las reglas para nombrar compuestos orgánicos e inorgánicos están contenidas en dos publicaciones, conocidas como el Libro Azul y el Libro Rojo, respectivamente. Una tercera publicación, conocida como el Libro Verde, describe las recomendaciones para el uso de símbolos para cantidades físicas (en asociación con la IUPAP), mientras que el cuarto, el Libro Dorado, contiene las definiciones de un gran número de términos técnicos usados en química. Una compilación similar existe para la bioquímica (en asociación con el IUBMB), el análisis químico y la química macromolecular. Estos libros están complementados por unas cortas recomendaciones para circunstancias específicas las cuales son publicadas de vez en cuando en la Revista de Química Pura y Aplicada.
RESPECTO A LA NOMENCLATURA QUÍMICA DE LOS COMPUESTOS INORGÁNICOS
Para iniciar el estudio de la nomenclatura es necesario distinguir primero entre compuestos orgánicos e inorgánicos. Los compuestos orgánicos son los que contienen carbono, comúnmente enlazados con hidrógeno, oxígeno, boro, nitrógeno, azufre y algunos halógenos. El resto de los compuestos se clasifican como compuestos inorgánicos. Éstos se nombran según las reglas establecidas por la IUPAC.
Los compuestos inorgánicos se clasifican según la función química que contengan y por el número de elementos químicos que los forman, con reglas de nomenclatura particulares para cada grupo. Una función química es la tendencia de una sustancia a reaccionar de manera semejante en presencia de otra. Por ejemplo, los compuestos ácidos tienen propiedades características de la función ácido, debido a que todos ellos tienen el ion H+1; y las bases tienen propiedades características de este grupo debido al ion OH-1 presente en estas moléculas. Las principales funciones químicas son: óxidos, bases, ácidos y sales.
B.1. Sistemático
También llamada racional o estequiometrica. Se basa en nombrar a las sustancias usando prefijos numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula. La atomicidad indica el número de átomos de un mismo elemento en una molécula, como por ejemplo el agua con fórmula H2O, que significa que hay un átomo de oxígeno y dos átomos de hidrógeno presentes en cada molécula de este compuesto, aunque de manera más práctica, la atomicidad en una fórmula química también se refiere a la proporción de cada elemento en una cantidad determinada de sustancia. En este estudio sobre nomenclatura química es más conveniente considerar a la atomicidad como el número de átomos de un elemento en una sola molécula. La forma de nombrar los compuestos en este sistema es: prefijo-nombre genérico + prefijo-nombre específico (Véase en la sección otras reglas nombre genérico y específico).
(Generalmente solo se utiliza hasta el prefijo HEPTA).
Por ejemplo, CrBr3 = tribromuro de cromo; CO = monóxido de carbono
En casos en los que puede haber confusión con otros compuestos (sales dobles y triples, oxisales y similares) se pueden emplear los prefijos bis-, tris-, tetras-, etc.
Por ejemplo la fluorapatita Ca5F (PO4)3 = fluoruro tris (fosfato) de calcio, ya que si se usara el término trifosfato se estaría hablando del anión trifosfato [P3O10]5-, en cuyo caso sería: Ca5F (P3O10)3.
B.2. Antiguo o tradicional
En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son:
-
Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” y en algunos casos se puede optar a usar el sufijo –ico.
K2O, óxido de potasio u óxido potásico.
-
Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.
… -oso cuando el elemento usa la valencia menor: Fe+2O-2, hierro con la valencia +2, óxido ferroso
… -ico cuando el elemento usa la valencia mayor: Fe2+3O3-2, hierro con valencia +3, óxido férrico2
-
Cuando tiene tres distintas valencias se usan los prefijos y sufijos.
hipo- … -oso (para la menor valencia)
… -oso (para la valencia intermedia)
… -ico (para la mayor valencia)
-
Cuando entre las valencias se encuentra el 7 se usan los prefijos y sufijos.
hipo- … -oso (para las valencias 1 y 2)
… -oso (para la valencias 3 y 4)
… -ico (para la valencias 5 y 6)
per- … -ico (para la valencia 7):
Ejemplo: Mn2+7O7-2, óxido permangánico (ya que el manganeso tiene más de tres números de valencia y en este compuesto está trabajando con la valencia 7).
B.3. Stock
Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos la valencia atómica del elemento con “nombre específico”. La valencia (o número de oxidación) es el que indica el número de electrones que un átomo pone en juego en un enlace químico, un número positivo cuando tiende a ceder los electrones y un número negativo cuando tiende a ganar electrones. De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico + de + nombre del elemento específico + el No. de valencia. Normalmente, a menos que se haya simplificado la fórmula, la valencia puede verse en el subíndice del otro elemento (en compuestos binarios y ternarios). Los números de valencia normalmente se colocan como superíndices del átomo (elemento) en una fórmula molecular.
Alternancia de valencias
Ejemplo: Fe2+3S3-2, sulfuro de hierro (III)
C. Tipos de compuestos inorganicos
Se denomina compuesto químico inorgánico a todos aquellos compuestos que están formados por distintos elementos, pero en los que su componente principal no siempre es el carbono, siendo el agua el más abundante. En los compuestos inorgánicos se podría decir que participan casi la totalidad de elementos conocidos.
Mientras que un compuesto orgánico se forma de manera natural tanto en animales como en vegetales, uno inorgánico se forma de manera ordinaria por la acción de varios fenómenos físicos y químicos: electrólisis, fusión, etc. También podrían considerarse agentes de la creación de estas sustancias a la energía solar, el agua, el oxígeno.
Los enlaces que forman los compuestos inorgánicos suelen ser iónicos o covalentes.
Ejemplos de compuestos inorgánicos:
-
Cada molécula de cloruro de sodio (NaCl) está compuesta por un átomo de sodio y otro de cloro.
-
Cada molécula de agua (H2O) está compuesta por dos átomos de hidrógeno y uno de oxígeno.
-
Cada molécula de amoníaco (NH3) está compuesta por un átomo de nitrógeno y tres de hidrógeno.
-
El anhídrido carbónico se encuentra en la atmósfera en estado gaseoso y los seres vivos aerobios lo liberan hacia ella al realizar la respiración. Su fórmula química, CO2, indica que cada molécula de este compuesto está formada por un átomo de carbono y dos de oxígeno. El CO2 es utilizado por algunos seres vivos autótrofos como las plantas en el proceso defotosíntesis para fabricar glucosa. Aunque el CO2 contiene carbono, no se considera como un compuesto orgánico porque no contiene hidrógeno.
C.1. Binarios
Óxidos
Un óxido es la combinación de cualquier elemento con el oxígeno. Todos reciben la denominación óxido de, salvo el compuesto con hidrógeno, que se llama agua.
Para formular los óxidos, escribimos en primer lugar el elemento del que se desea formular el óxido, con el subíndice 2 y a continuación el símbolo del oxígeno, que llevará como subíndice la valencia del elemento.
Si la valencia es par, se simplifican ambos subíndices y no se escribe el subíndice 1
Peróxidos y superóxidos
Un peróxido es la combinación de un metal o el hidrógeno con el grupo peróxido (O2-2). Si la valencia es par, se simplifican ambos subíndices y no se escribe el subíndice 1.
Un superóxido o hiperóxido es la combinación de un metal con el grupo O2-1.
Hidruros metálicos
Los hidruros metálicos resultan de la combinación del hidrógeno con un metal.
El hidrógeno actúa con estado de oxidación -1.
Se formulan escribiendo en primer lugar el símbolo del metal correspondiente y después el símbolo del hidrógeno, que llevará como subíndice la valencia del metal
Sales binarias (metal-no metal)
Las sales binarias son combinaciones de un metal con un no metal o dos no metales entre sí.
En los compuestos de un metal y un no metal, el no metal actúa siempre con su estado de oxidación negativo.
Para formularlos, se escribe en primer lugar el símbolo químico del metal, a continuación el del no metal y se intercambian las valencias.
Si ambas valencias son divisibles por el mismo número, se realiza la división y se coloca el cociente.
Prefijos Griegos
Numero de atomos
mono-
di-
tri-
tetra-
penta-
hexa-
hepta-
oct-
non- nona- eneá-
deca-
1
2
3
4
5
6
7
8
9
10






C.2. Ternarios
Hidróxidos
Aunque formados por tres elementos distintos, los hidróxidos se comportan como compuestos binarios, ya que el ión negativo o anión hidróxido (OH-) actúa siempre como una unidad conjunta. Todos reciben la denominación hidróxido de ... y se forman con un metal.
Para formular los hidróxidos, escribimos en primer lugar el símbolo del metal, a continuación el grupo hidróxido, entre paréntesis, que llevará como subíndice la valencia del metal.
Si la valencia es 1 no se necesita escribirla ni poner los paréntesis.
Oxoácidos u oxiácidos
Los ácidos u oxiácidos son compuestos ternarios, formados por tres elementos distintos: hidrógeno, que actúa con su estado de oxidación +1, oxígeno, que siempre actúa con estado de oxidación -2 y un tercer elemento de la tabla periódica, que actuará con un estado de oxidación positivo.
La fórmula de los oxiácidos empieza por el símbolo del hidrógeno, a continuación el símbolo del elemento y, finalmente, el símbolo del oxígeno, cada uno con un subíndice de forma que la suma de los estados de oxidación de los átomos de la fórmula sea 0.
Oxisales
Para formular una sal, se escribe en primer lugar el catión, después el anión, y se intercambian las valencias. Si se puede, los subíndices se simplifican y si alguno vale 1 no se escribe.
C.3. Cuaternarios
Sales ácidas
Son derivados de oxoácidos polipróticos (con más de un hidrógeno), en los que se sustituye uno o más hidrógenos por cationes metálicos.
Se formulan igual que las oxisales, comenzando por el catión seguido por el oxoanión, que contiene uno o más hidrógenos.
También se consideran sales ácidas aquéllas que proceden de sustituir un hidrógeno en los ácidos hidrácidos.
Sales básicas
Se forman cuando en una reacción de neutralización existe un exceso de hidróxido con respecto al ácido.
Son compuestos que poseen algún grupo OH en su estructura.
Para formularlas, se escribe primero el catión y luego los aniones en orden alfabético.
D. Estequiometría de fórmulas
Las transformaciones que ocurren en una reacción quimica se rigen por la Ley de la conservación de la masa: Los átomos no se crean ni se destruyen durante una reacción química.
Entonces, el mismo conjunto de átomos está presente antes, durante y después de la reacción. Los cambios que ocurren en una reacción química simplemente consisten en una reordenación de los átomos.
Por lo tanto una ecuación química ha de tener el mismo número de átomos de cada elemento a ambos lados de la flecha. Se dice entonces que la ecuación está balanceada.
D.1. Concepto de mol , masa molar , volumen molar y numero de avogadro
Mol: es una unidad de cantidad de materia un mol representa la cantidad de masa contenido en 6,022 x 1023 moleculas de sustancia. El numero 6,022 x 1023 es conocido como el munero de Avogadro . el mol es una unidad algo peculiar, por que “ no pesa lo mismo “ en cada caso. Al estar basado en un conteo de atomos o moléculas, la cantidad de masa total dependerá de cuanta masa tenga cada unidad material.
Masa molar: se refiere a la masa de un mol de unas ciertas sustancias expresadas en gramos. Un mol, ´por un parte, es la cantidad de sustancias que contiene tantas entidasdes elementales (atomos , moléculas, iones, etc.) de un tipo como atomos presentes en doces gramos de carbono – 12 .
Volumen molar: es un concepto que se utiliza en el ámbito de la química. La nocion se emplea para nombrar al volumen ocupado por un mol de una sustancias, utilizándose como unidad de referencia al metro cubico por mol.
Numero de Avogadro: se entiende al numero de entidades elementales (es decir de atomos , electrones, iones, moléculas) que existen en un mol de cualquier sustancia.
D.2. Porcentaje de composición
Conocida la fórmula de un compuesto químico, es posible saber el porcentaje de masa con el que cada elemento que forma dicho compuesto está presente en el mismo.
Una molécula de dióxido de azufre, (SO2), contiene un átomo de azufre y dos de oxígeno. Calcular la composición en tanto por ciento de dicha molécula.
Datos: la masa atómica del azufre es 32,1 y la del oxígeno, 16,0 u.
El problema puede resolverse por dos vías:
1. Utilizando unidades de masa atómica:
-
Masa molecular del SO2 = (32,1) + (2 · 16) = 64,1 u .
-
Porcentaje de azufre en el compuesto: (32'1 / 64'1) x (100) = 50'078%
-
Porcentaje de oxígeno en el compuesto: (32 / 64'1) x (100) = 49'92%
2. Utilizando gramos:
-
1 mol de moléculas de SO2 (64,1 g) contiene 1 mol de átomos de azufre (32,1 g) y 2 moles de átomos de oxígeno (16,0 g).
-
Porcentaje de azufre en el compuesto: Si en 64,1 g de SO2 hay ® 32,1 g de azufre, en 100 g habrá ® x, luego x = 50'078%
-
Porcentaje de oxígeno en el compuesto: Si en 64,1 g de SO2 hay ® 32,0 g de oxígeno, en 100 g habrá ® x, luego x = 49'92%.
D.3. Formula empírica y Formula Verdadera
-
Formula empírica: es una expresión que representa la proporción mas simple en la que esta presente los atomos que forman un compuesto quimico. Se determina apartir de datos esperimentales lo que significa que parte ello se deben conocer la cantidad en gramos de cada elemnto que se combina para formar determinados compuesto o también se puede tener el porcentaje de cada elementos presente en el representación mas sencilla de un compuesto. Por ello , aveces, se le llama formula, minima.
-
Formula Verdaderas: indica el tipo de atomos presente en un compuesto molecular , y el numero de atomos de cada clase. Solo tiene sentido hablar de formula molecular en compuestos covalentes. Estos brindan mas información que las empíricas , cuando se tiene la formula molecular es posible sacar la formula empírica pero cuando se intenta al revés no se cumple ya que si se tiene la formula empírica pero no se tiene la información no es posible encontrar la formula molecular.


Cuaternarias







ii. Las reacciones químicas
Concepto
La reacción química es aquel proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos. Mientras tanto, las sustancias pueden ser elementos químicos (materia constituida por átomos de la misma clase) o compuestos químicos (sustancia que resulta de la unión de dos o más elementos de la tabla periódica).
El ejemplo más corriente de una reacción química es la formación de óxido de hierro, que resulta de la reacción del oxígeno del aire con el hierro.
Los productos que se obtienen de ciertos reactivos dependerán de las condiciones persistentes en la reacción química en cuestión, aunque, si bien es una realidad esto que se sostiene que los productos varían de acuerdo a las condiciones, determinadas cantidades no sufren ningún tipo de modificación y por tanto permanecen constantes en cualquier reacción química.
La física reconoce dos grandes modelos de reacciones químicas, las reacciones ácido-base, que no presentan modificaciones en los estados de oxidación y las reacciones redox, que por el contrario sí presentan modificaciones en los estados de oxidación.
En tanto, dependiendo del tipo de productos que resulta de la reacción a las reacciones químicas se las clasifica de la siguiente manera: reacción de síntesis (elementos o compuestos simples se unen para conformar un compuesto más complejo), reacción de descomposición (el compuesto se fragmenta en elementos o compuestos más simples; un solo reactivo se convierte en productos), reacción de desplazamiento o simple sustitución (un elemento reemplaza a otro en un compuesto) y reacción de doble desplazamiento o doble sustitución (los iones de un compuesto modifican lugares con los propios de otro compuesto para conformar dos sustancias diferentes).
A. Componentes de una reacción química
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química.
A.1. Tipos de reacciones químicas
Reacciones de la química Inorganica
Desde un punto de vista de la química inorgánica se puede postular dos grandes modelos para las reacciones químicas de los compuestos inorgánicos reacciones acidobase o de neutralización (sin cambios en los estados de oxidación) y reacciones redox (con cambio en los estados de oxidación) sin embargo, podemos clasificarlas deacuerdo con el mecanismo de reacción y tipo de productos que resulta de la reaccion.
Reacciones de la química Organica
nos referimos a ellas teniendo como base a diferentes tipos de compuestos como alcanos, alquenos, alquinos, alcoholes, aldeidos, acetonas, etc. Que encuentra su clasificación , reactividad y/o propiedades químicas en el grupo funcional que contienen y este ultimo será el responsable de los cambios en la estructura y composición de la materia. Entre los grupos funcionales mas importantes tenemos a los dobles y triples enlaces y a los grupos hidróxido, carbonilo y nitro.
A.1.1. Reacciones de Sintesis o Composicion
Son elementos compuestos sencillos que se reúnen para formar un compuesto mas complejo.la siguiente es la forma general que presenta este tipo de reacciones : representación A+B → AB ; dnde A y B representan cualquier sustancia química . un ejemplo de esta reacción es la síntesis del Cloruro de sodio.
A.1.2. Reacciones de Descomposicion o Analisis
Un compuesto se fragmenta en elementos o compuesto mas sencillos. En este tipo de reacción un solo reactivo se conviere en zonas o productos. AB → A+B ; donde A y B representan cualquier sustancia química . un ejemplo de este tipo de reacción es la descomposición del agua.
A.1.3. Reacciones de Desplazamiento o Sustitución Sencilla
Estas reacciones son aquellas en las cuales un átomo toma el lugar de otro similar pero menos activo en un compuesto. En general, los metales reemplazan metales (o al hidrógeno de un ácido) y los no metales reemplazan no metales. La actividad de los metales es la siguiente, en orden de mayor actividad a menor actividad: Li, K, Na, Ba, Ca, Mg, Al, Zn, Fe, Cd, Ni, Sn, Pb, (H), Cu, Hg, Ag, Au. El orden de actividad de los no metales mas comunes es el siguiente: F, O, Cl, Br, I, siendo el flúor el más activo.
A.1.4. Reacciones de Doble Desplazamiento o Intercambio
También llamada de doble descomposición o metátesis, es una reacción entre dos compuestos que generalmente están cada uno en solución acuosa. Consiste en que dos elementos que se encuentran en compuestos diferentes intercambian posiciones, formando dos nuevos compuestos. Estasreacciones quimicas no presentan cambios en el numero de oxidación o carga relativa de los elementos, por lo cual también se le denominan reacciones NO – REDOX.
A.1.5. Reacciones de Neutralización
Las reacciones de neutralización, son las reacciones entre un ácido y una base, con el fin de determinar la concentración de las distintas sustancias en la disolución.
Tienen lugar cuando un ácido reacciona totalmente con una base, produciendo sal y agua. Sólo hay un único caso donde no se forma agua en la reacción, se trata de la combinación de óxido de un no metal, con un óxido de un metal.
Ácido + base → sal + agua
Por ejemplo: HCl + NaOH → NaCl + H2O
Las soluciones acuosas son buenas conductoras de la energía eléctrica, debido a los electrolitos, que son los iones positivos y negativos de los compuestos que se encuentran presentes en la solución.
Una buena manera de medir la conductancia es estudiar el movimiento de los iones en una solución.
A.1.6. Reacciones de Combustión
La reacción de combustión puede llevarse a cabo directamente con el oxigeno o bien con una mezcla de sustancias que contengan oxígeno, llamada comburente, siendo el aire atmosférico el comburente mas habitual.
La reacción del combustible con el oxígeno origina sustancias gaseosas entre las cuales las más comunes son CO2 y H2O. Se denominan en forma genérica productos, humos o gases de combustión. Es importante destacar que el combustible solo reacciona con el oxigeno y no con el nitrógeno, el otro componente del aire. Por lo tanto el nitrógeno del aire pasará íntegramente a los productos de combustión sin reaccionar.
De acuerdo a como se produzcan las reacciones de combustión, estas pueden ser de distintos tipos:
a) Combustión completa
Ocurre cuando las sustancias combustibles reaccionan hasta el máximo grado posible de oxidación. En este caso no habrá presencia de sustancias combustibles en los productos o humos de la reacción.
b) Combustión incompleta
Se produce cuando no se alcanza el grado máximo de oxidación y hay presencia de sustancias combustibles en los gases o humos de la reacción.
c) Combustión estequiométrica o teórica
Es la combustión que se lleva a cabo con la cantidad mínima de aire para que no existan sustancias combustibles en los gases de reacción. En este tipo de combustión no hay presencia de oxígeno en los humos, debido a que este se ha empleado íntegramente en la reacción.
d) Combustión con exceso de aire
Es la reacción que se produce con una cantidad de aire superior al mínimo necesario. Cuando se utiliza un exceso de aire, la combustión tiende a no producir sustancias combustibles en los gases de reacción. En este tipo de combustión es típica la presencia de oxígeno en los gases de combustión.
La razón por la cual se utiliza normalmente un exceso de aire es hacer reaccionar completamente el combustible disponible en el proceso.
e) Combustión con defecto de aire
Es la reacción que se produce con una menor cantidad de aire que el mínimo necesario. En este tipo de reacción es característica la presencia de sustancias combustibles en los gases o humos de reacción.
B. Balances de una reacción química
Balancear una ecuación química es igualar el número y clase de átomos, iones o moléculas reactantes con los productos, con la finalidad de cumplir la ley de conservación de la masa
Para conseguir esta igualdad se utilizan los coeficientes estequiométricos, que son números grandes que se colocan delante de los símbolos o fórmulas para indicar la cantidad de elementos o compuestos que intervienen en la reacción química. No deben confundirse con los subíndices que se colocan en los símbolos o fórmulas químicas, ya que estos indican el número de átomos que conforman la sustancia. Si se modifican los coeficientes, cambian las cantidades de la sustancia, pero si se modifican los subíndices, se originan sustancias diferentes.
Para balancear una ecuación química, se debe considerar lo siguiente:
• Conocer las sustancias reaccionantes y productos.
• Los subíndices indican la cantidad del átomo indicado en la molécula.
• Los coeficientes afectan a toda la sustancia que preceden.
• El hidrógeno y el oxígeno se equilibran al final, porque generalmente forman agua (sustancia de relleno). Esto no altera la ecuación, porque toda reacción se realiza en solución acuosa o produce sustancias que contienen agua de cristalización.
Ej. :
2 H2SO4
Significa:
Hay dos moléculas de ácido sulfúrico ( o dos moles)
En cada molécula hay dos átomos de hidrógeno, un átomo de azufre y cuatro átomos de oxígeno.
B.1. Metodo de tanteo
Se emplea para balancear ecuaciones sencillas. Se realiza al "cálculo" tratando de igualar ambos miembros. Para ello utilizaremos el siguiente ejemplo:
Balancear:
N2 + H2 NH3
Identificamos las sustancias que intervienen en la reacción. En este caso el nitrógeno y el hidrógeno para obtener amoniaco.
Se verifica si la ecuación está balanceada o no. En este caso notamos que ambos miembros no tienen la misma cantidad de átomos, por lo tanto no está balanceada.
Se balancea la ecuación colocando coeficientes delante de las fórmulas o símbolos que los necesitan. Empezar con los elementos metálicos o por el que se encuentra presente en menos sustancias:
Primero balanceamos el nitrógeno: N2 + H2 2 NH3
El hidrógeno y oxígeno quedarán para el final. Seguidamente balanceamos el hidrógeno:
N2 + 3 H2 2 NH3.
Si un coeficiente no es entero, entonces debe multiplicar todos por el mayor de los denominadores. En este caso no ocurre.
Como es un tanteo, debe recordar que las reglas indicadas, son recomendaciones. Aún así, para cualquier ejercicio, empiece usted, por donde desee pero tomando como parámetro que el número de átomos de este elemento está definido en uno de los miembros.




Inorganica
Organica





B.2. Metodo Algebraico
El método más usado para balancear una ecuación química es el del método algebraico, el cual se vale de cualquier tipo de brujería u operaciones matemáticas que utilicemos para poder resolver las ecuaciones algebraicas que nos generen cada uno de los elementos que forman los compuestos que a su vez son parte de estas ecuaciones. Estas operaciones matemáticas pueden ir desde sumas hasta resolver complejos y algo trolls sistemas de ecuaciones a través de los cuales cumpliremos nuestro objetivo.
Ya hemos hablado mucho acerca de lo bondadoso que es el uso de este método para balancear ecuaciones químicas, pero ahora vamos como los pollos: al grano. Este método consiste en que veremos la cantidad de compuestos que forman parte de nuestra ecuación química y a cada compuesto le asignaremos una letra del abecedario, por ejemplo supongamos que hay 4 compuestos, entonces podríamos usar las letras A, B, C y D, que no necesariamente tiene que ser en orden alfabético, pero es recomendable. Una vez que hayamos hecho esto procederemos a ver que elementos forman parte de todos estos compuestos, supongamos que tenemos la siguiente ecuación, la cual es de un compuesto que nos hace estar muy salados en muchas ocasiones (mal chiste), la sal de mesa o con su nombre químico el cloruro de sodio.
Na + Cl2 —> NaCl
a b c
En esa ecuación podemos observar que hay dos elementos, el sodio (Na) y el Cloro (Cl) que como se encuentra en su estado fundamental es diatómico (Es decir, que tiene dos átomos. O sea que ya no hay un cloro, sino dos cloros. Advierto que Clorox no esta patrocinando este post.). Cuando ya identificamos cuales son los elementos que forman parte de esta ecuación, procederemos a ir compuesto por compuesto para armar las ecuaciones individuales de cada elemento. Veamos primero cuanto Sodio (Na) hay en nuestro primer compuesto (compuesto A), vemos que hay un Sodio, verificamos si en otro compuesto hay algún otro Sodio y vemos que en el Cloruro de Sodio hay uno más, entonces procedemos a armar la ecuación individual para el Sodio que sería a = c. Pero muchos se preguntaran: ¿Porqué de la nada pasamos esos números a letras? Bueno, aquí es que está el truco de todo esto, la cantidad de átomos que haya de un elemento en un compuesto (guiarse por el subíndice perteneciente a ese elemento) nos va a indicar el numero que colocaremos delante de la letra que le asignamos originalmente a dicho compuesto.
Para comprender ese punto mejor veamos el caso del Cl2 (Cloro), vemos que el subíndice del Cloro nos indica que hay dos átomos del mismo y esos dos átomos se encuentran en el compuesto al que le asignamos la letra b, entonces para armar nuestra ecuación individual del cloro vamos a colocar 2b = (El igual lo colocamos para denotar que no hay mas átomos de ese elemento en ningún otro compuesto que se encuentre del lado de los reactivos, y que comenzaremos a colocar los átomos de dicho elemento que están del lado de los productos) c, porque del lado de los reactivos en el compuesto que denotamos con la letra C hay un átomo de Cloro (Cl).
Una vez tengamos todas las ecuaciones para cada uno de todos los elementos que formen parte de esta ecuación química, vamos a poder utilizar lo que yo llamaría “El comodín del balanceo” que consiste en darle el valor de “1” a algunas de las variables alfabéticas, que en este caso son A, V y C de manera que al darle dicho valor, utilizando métodos como despeje, sistemas de ecuaciones y demás brujerías matemáticas podamos encontrar el valor que representan cada una de ellas y ese número que fue nuestro resultado será el que colocaremos delante del compuesto que la acompaña, es decir: Si el valor de A = 2 entonces nos fijamos en nuestra ecuación que el compuesto con la letra A es el Na y para armar la ecuación final balanceada pondríamos 2Na. En muchos casos se tiene tendencia a que si el valor de la variable es 1, se obviá en la ecuación y se deja sin nada delante del compuesto. Es decir: Si a = 1, entonces el Sodio quedaría en la ecuación final balanceada como Na.
B.3 Balanceo de las ecuaciones Redox
En química los compuestos cuando se unen ya sea a través de uniones covalentes o iónicas, algunos de sus elementos pierden o ganan electrones. Esta cantidad está determinada por un número llamado número de oxidación o estado de oxidación. Cuando este es negativo, indica que el elemento capta electrones al unirse con otro de número más positivo y viceversa, los que tienen números positivos tienen tendencia a donar electrones.
El proceso por el cual un elemento o compuesto cede electrones a otro se llama oxidación. Al proceso contrario lo llamamos reducción. Es decir, si un compuesto perdió electrones, se oxido. El que gana se reduce. Obviamente deducimos que estos dos procesos no pueden estar aislados, se dan en conjunto. Ya que si hay un compuesto oxidado debe haber otro reducido. También se menciona como oxidante aquel que oxida a otro (le quita electrones) y reductor aquel que reduce a otro (le cede electrones). A veces esto presta a confusión porque parece un juego de palabras pero no es así.
Agente Reductor Agente Oxidante
Se oxida Se reduce
Reduce a otro Oxida a otro
Pierde electrones Gana electrones
A las reacciones que involucran intercambio de electrones por lo tanto de cargas se las llama reacciones Redox. En química la gran mayoría de las reacciones son del tipo redox. Aunque no todas. Para distinguir las que son redox de las que no lo son debemos saber si las sustancias participantes o alguno de sus elementos han cambiado su número de oxidación. Para esto, hay que saber las reglas básicas que a continuación pondré.
El número de oxidación total (sumado todos sus elementos) de un compuesto es cero.
El número de oxidación de un elemento solo (no combinado) es cero.
El numero de oxidación del oxigeno es -2. Salvo en los peróxidos donde usa el -1
El numero de oxidación del hidrogeno es +1 salvo cuando esta combinado con un metal, allí es -1.
Los números de oxidación de los metales alcalinos (grupo 1) es +1 y el de los alcalinotérreos (grupo 2) es +2.
El número de oxidación de los halógenos como el cloro, bromo e Iodo en los hidrácidos y en las sales no oxigenadas es -1. Ej: NaCl (Cloruro de Sodio), Li I (Yoduro de Litio).
Con estas reglas podemos hallar los números de oxidación de un elemento dentro de un compuesto y así determinar si hubo reducción u oxidación. Algunos ejemplos:
SO4 H2 + Fe —— > SO4 Fe + H2
Aquí podemos ver que el hierro el estar solo tiene como número de oxidación al 0. Después en el compuesto sulfato ferroso obviamente que ha cambiado su número y lo podemos determinar de la siguiente manera.
Antes debemos saber el número de oxidación del azufre. En el ácido sulfúrico el azufre esta combinado con el oxigeno y el hidrogeno. Aplicando las reglas podemos saber el número del azufre, planteando una ecuación.
S + 4.(-2) + 2.(+1) = 0
Los números entre paréntesis corresponden a los números de oxidación del oxigeno y el hidrogeno respectivamente. Los valores 4 y 2 corresponden a las cantidades de los átomos de oxigeno e hidrogeno en ese mismo orden. S corresponde al azufre que también lo podemos poner como una X ya que es la incógnita.
Resolviendo la ecuación nos dará:
S + (-8) + 2 = 0
S – 8 + 2 = 0
S – 6 = 0
S = + 6
De esta forma hallamos el número de oxidación del azufre. Ahora si procederemos para hallar el del hierro de la misma manera.
+6 + 4.(-2) + Fe = 0
+6 – 8 + Fe = 0
-2 + Fe = 0
+Fe = +2
Después de tener estos valores es fácil deducir que el hierro se oxido ya que paso de 0 a +2. Por otra parte el azufre mantuvo su estado de oxidación y el hidrogeno cambio de +1 a 0 ya que figura como no combinado en el lado de los productos, a la derecha. Por lo tanto se redujo.
Así debemos proceder con cualquier reacción en la que se manifieste cambios en el estado de oxidación.
Saber esto no solo sirve para determinar los estados de oxidación en si sino también para equilibrar las reacciones que muchas veces se nos presentan en química. Por ejemplo:
I2 + HNO3 → HIO3 + NO2 + H2O
Procederemos como antes. El yodo a simple vista vemos que pasa de 0 por estar solo a otro valor que determinaremos.
El hidrógeno y oxigeno no cambian en condiciones normales así que el nitrógeno es el otro par redox. El estado de oxidación de este en el ácido nítrico es:
+1 + N + 3.(-2) = 0
N +1 -6 = 0
N = +5
En el Dióxido de Nitrógeno:
N + 2.(-2) = 0
N -4 = 0
N = +4
Para el yodo en el ácido yódico (producto).
+1 + Y + 3.(-2) = 0
Y +1 -6 = 0
Y = +5
Ahora que sabemos que el yodo se oxido de o a +5 y que el nitrógeno se redujo de +5 a +4 aplicaremos el método más usado para equilibrar para el balance de reacciones redox. El método del ión electrón.
Para esto primero debemos expresar en iones a los compuestos participantes, es decir, que han sufrido el cambio de sus estados de oxidación. En este ejemplo queda exenta el agua.
Haremos un repaso de cómo se separan en iones las principales sustancias.
Los ácidos: Estos se separan por un lado el hidrógeno con carga positiva y por otro el resto de la molécula (anión), por otro. Ej:
H2SO4 → 2 H+ + SO4-2
Hidróxidos: Por un lado el radical oxhidrilo (anión) y por otro el metal positivo (catión). Ej:
Ca(OH)2 → Ca++ + 2 (OH–)
En el caso de las sales: El metal positivo por un lado y el anión aparte
Al (NO3)3 → Al+3 + 3 NO3–
En todos los casos obsérvese que las cargas positivas y negativas deben estar perfectamente balaceadas.
Volviendo a nuestro ejercicio.
I2 + HNO3 → HIO3 + NO2 + H2O
Esta reacción la separaremos en dos. La de oxidación y la de reducción. También llamadas hemireacciones.
I2 → IO3–
Esta es la de oxidación ya que recordemos que el yodo pasó de 0 a +5. Pero tenemos que balancearla. Cuando se balancean ecuaciones redox se equilibra primero la parte material, es decir, la cantidad de átomos y después la parte eléctrica que representa a las cargas.
Primero colocamos un 2 a la derecha para equilibrar la cantidad de átomos de yodo.
I2 → 2 IO3–
Luego equilibramos la cantidad de oxígenos a la izquierda poniendo tantas moléculas de agua como oxígenos necesitemos. En este caso 6.
I2 + 6 H2O → 2 IO3–
Ahora aparece el hidrógeno que antes no estaba, por lo tanto también debemos encargarnos de él. Colocaremos tantos cationes hidrógenos como hagan falta del lado derecho. En este caso 12.
I2 + 6 H2O → 2 IO3– + 12 H+
En este momento el equilibrio material llega a su fin. Ahora hay que hacerlo con las cargas. Del lado izquierdo no tenemos cargas, pero a la derecha hay en total 2 negativas y 12 positivas. Dando una carga neta de 10 positivas. Entonces colocamos de este mismo lado unas 10 cargas negativas o sea electrones.
I2 + 6 H2O → 2 IO3– + 12 H+ + 10 e–
No significa que siempre los electrones vayan a la derecha, se ponen donde haga falta para tener a ambos lados de la ecuación la misma carga ya sea 0 en ambas partes o +2 y +2 o -3 y -3. Todo depende de la reacción.
Ahora nos encargaremos de la hemireacción de reducción.
El nitrógeno +5 del HNO3 pasa al nitrógeno +4 del NO2.
NO3– → NO2
En este caso debemos equilibrar al oxigeno ya que tenemos 3 a la izquierda y 2 a la derecha. Colocamos una molécula de agua a la derecha.
NO3– → NO2 + H2O
Ahora 2 cationes hidrogeno a la izquierda.
NO3– + 2 H+ → NO2 + H2O
Para terminar equilibramos las cargas con electrones. Tenemos a la izquierda una carga negativa y 2 positivas. O sea una carga neta de +1. Por lo tanto debemos colocar un electrón aquí mismo para tener en ambos miembros una carga neta de 0.
NO3– + 2 H+ + 1e– → NO2 + H2O
Ahora juntaremos ambas hemireacciones para formar la reacción total final balanceada.
I2 + 6 H2O → 2 IO3– + 12 H+ + 10 e–
NO3– + 2 H+ + 1e– → NO2 + H2O
Notamos que en la de oxidación hay 10 electrones e juego y en la de reducción hay solo 1. Eso lo balanceamos porque la cantidad de electrones debe coincidir ya que los electrones que se pierden en una reacción deben aparecer en la otra. Tendremos que multiplicar a la reacción de abajo por 10.
I2 + 6 H2O → 2 IO3– + 12 H+ + 10 e–
10 NO3– + 20 H+ + 10e– → 10 NO2 + 10 H2O
Ahora podremos cancelar a los electrones. Como a los 12 H+ de la reacción de arriba con 12 de los 20 de la reacción de abajo por repetirse quedándose esta con 8 H+. Las 6 moléculas de agua de arriba se irán con 6 de las 10 que hay abajo quedando solo 4 de agua abajo.
I2 → 2 IO3–
10 NO3– + 8 H+ → 10 NO2 + 4 H2O
Sumando todos los términos de la derecha y los de la izquierda tenemos la reacción final perfectamente balanceada.
I2 + 10 NO3– + 8 H+ → 2 IO3– + 10 NO2 + 4 H2O
Este equilibrio lo hicimos en medio acido. Cuando se hace en medio acido se usan los H+. Los ejercicios nos deben generalmente decir cómo equilibrar, si en medio ácido o en básico. Veremos un ejemplo de medio básico.
KClO + KAsO2 + KOH → K3AsO4 + KCl + H2O
Es evidente que el cloro y el arsénico son los que cambian sus números de oxidación. Ya que el oxigeno, hidrogeno y el metal alcalino potasio son estables a no ser que aparezcan solos, o que el agua pase a peróxido, no cambiaran sus estados de oxidación.
Se puede determinar con la técnica matemática que se expuso antes que el arsénico pasa de +3 a +5. Y que el cloro pasa de +1 a -1.
La hemirreacción de oxidación será:
AsO2-1 → AsO4-3
Al principio procederemos como el medio ácido. Equilibramos con moléculas de agua donde hay déficit de oxigeno.
AsO2-1 + 2 H2O → AsO4-3
Después balanceamos el hidrogeno colocando los 4H+ al lado derecho.
AsO2-1 + 2 H2O → AsO4-3 + 4 H+
Añadimos tantos OH– como cationes H+ hay a ambos lados de la hemirreaccion.
AsO2-1 + 2 H2O + 4 OH– → AsO4-3 + 4 H+ + 4 OH–
Los cationes H+ y los aniones OH– se unen formando moléculas de agua.
AsO2-1 + 2 H2O + 4 OH– → AsO4-3 + 4 H2O
Simplificamos las moléculas de agua y equilibramos por ultimo las cargas con electrones.
AsO2-1 + 4 OH– → AsO4-3 + 2 H2O + 2 e–
La hemirreacción de reducción es:
ClO– → Cl–
Realizamos los mismos pasos que para la de oxidación.
ClO– + 2 H+ → Cl– + H2O
ClO– + 2 H+ + 2 OH– → Cl– + H2O + 2 OH–
ClO– + 2 H2O → Cl– + H2O + 2 OH
Podemos simplificar el agua ya que tenemos dos moléculas a la izquierda y una a la derecha.
ClO– + H2O → Cl– + 2 OH–
Equilibramos con electrones quedando:
ClO– + H2O + 2e– → Cl– + 2 OH–
Ahora unificamos ambas hemireacciones para formar la total o definitiva.
AsO2-1 + 4 OH– → AsO4-3 + 2 H2O + 2 e–
ClO– + H2O + 2e– → Cl– + 2 OH–
AsO2-1 + 4 OH– + ClO– + H2O + 2e– → AsO4-3 + 2 H2O + 2 e– + Cl– + 2 OH–
Los electrones como están en la misma cantidad a ambos lados se pueden eliminar.
AsO2-1 + 4 OH– + ClO– + H2O → AsO4-3 + 2 H2O + Cl– + 2 OH–
Hacemos lo mismo con las moléculas de agua y los OH– ya que están a ambos lados.
AsO2-1 + 2 OH– + ClO– → AsO4-3 + H2O + Cl–
Hayamos como coeficiente nuevo el número 2 del OH– que se le aplicara al KOH. Con esto equilibramos definitivamente la reacción.
KClO + KAsO2 + 2 KOH → K3AsO4 + KCl + H2O
Muchos pensarán que se ha hecho mucho trabajo para encontrar un solo número. Quizá en algunos casos sea así pero en otros se hallan más números. Pero siempre hay que aplicar convenientemente el método por más que hallemos solo un coeficiente ya que es la manera más segura y correcta de equilibrar a las reacciones redox.
B.3.1 MEDIO ACIDO
En medio ácido se agregan hidronios (cationes) (H+
) Y agua (H
2O) a las semirreacciones para balancear la ecuación final.
Del lado de la ecuación que haga falta oxígeno se agregarán moléculas de agua, y del lado de la ecuación que hagan falta hidrógenos se agregarán hidronios.
Por ejemplo, cuando el Manganeso (II) reacciona con el Bismutato de Sodio.
Ecuación sin balancear:
Mn^{2+}_{(aq)} + BiO^{-}_{3(s)} \to Bi^{3+}_{(aq)} + MnO^{-}_{4(aq)}
Oxidación :Mn^{2+}_{(aq)} \to MnO^{-}_{4(aq)} + 5 e^-
Reducción :2e^- + BiO^{-}_{3(s)} \to Bi^{3+}_{(aq)}
Ahora tenemos que agregar los hidronios y las moléculas de agua donde haga falta hidrógenos y donde haga falta oxígenos, respectivamente.
Oxidación: \color{Blue}4H_2O\color{Black} + Mn^{2+}_{(aq)} \to MnO^{-}_{4(aq)} + \color{Blue}8 H^{+}_{(aq)} \color{Black} + 5 e^-
Reducción: 2e^- + \color{Blue}6H^+\color{Black} + BiO^{-}_{3(s)} \to Bi^{3+}_{(aq)} + \color{Blue}3H_2O\color{Black}
Las reacciones se balancearán al momento de igualar la cantidad de electrones que intervienen en ambas semirreacciones. Esto se logrará multiplicando la reacción de una semirreación por el número de electrones de la otra semirreacción (y, de ser necesario, viceversa), de modo que la cantidad de electrones sea constante.
Oxidación: ( 4H_2O + Mn^{2+}_{(aq)} \to MnO^{-}_{4(aq)} + 8 H^{+}_{(aq)} + \color{OliveGreen}5 e^-\color{Black} ) \color{Orange}\times 2\color{Black}
Reducción: ( \color{Orange}2e^-\color{Black} + 6H^+ + BiO^{-}_{3(s)} \to Bi^{3+}_{(aq)} + 3H_2O ) \color{OliveGreen}\times 5\color{Black}
Al final tendremos:
Oxidación: 8H_2O + 2Mn^{2+}_{(aq)} \to 2MnO^{-}_{4(aq)} + 16 H^{+}_{(aq)} + 10 e^-
Reducción: 10e^- + 30H^+ + 5BiO^{-}_{3(s)} \to 5Bi^{3+}_{(aq)} + 15H_2O
Como se puede ver, los electrones están balanceados, así que procedemos a sumar las dos semirreacciones, para obtener finalmente la ecuación balanceada.
\underline{
\left .
\begin{array}{rcl}
8H_2O + 2Mn^{2+}_{(aq)} \to 2MnO^{-}_{4(aq)} + 16 H^{+}_{(aq)} + 10 e^- \\
10e^- + 30H^+ + 5BiO^{-}_{3(s)} \to 5Bi^{3+}_{(aq)} + 15H_2O
\end{array}
\right \Downarrow +
}
14H^+_{(aq)} + 2Mn^{2+}_{(aq)} + 5NaBiO_{3(s)} \to 7H_2O + 2MnO^{-}_{4(aq)} + 5Bi^{3+}_{(aq)} + 5 Na^+_{(aq)}
B.3.2 MEDIO BASICO
En medio básico se agregan iones hidróxidos (aniones) (OH−
) y agua (H
2O) a las semirreacciones para balancear la ecuación final.
Por ejemplo, tenemos la reacción entre el Permanganato de Potasio y el Sulfito de Sodio.
