
League of Chemistry
Resuemenes
mol, masa molar, volumen molar y número de Avogadro
I. Mol
En primer lugar, es conveniente distinguir entre los conceptos de masa y peso.
-
La masa se refiere a la cantidad de materia contenida en un cuerpo. Se mide en kilogramos (kg).
-
El peso es el resultado de la atracción gravitacional sobre la masa de un cuerpo. Se mide en Newton(N).
El mol es una unidad de cantidad de materia. Un mol representa la cantidad de masa contenida en 6,022 x 1023 moléculas de sustancia. El número 6,022 x 1023 es conocido como el número de Avogadro. El mol es una unidad algo peculiar, porque "no pesa lo mismo" en cada caso. Al estar basada en un conteo de átomos o moléculas, la cantidad de masa total dependerá de cuánta masa tenga cada unidad material.
Así, un mol de hidrógeno molecular (H2) tiene 2 gramos de masa, mientras que un mol de agua (H2O) contiene 18 gramos de masa. Un mol "pesa" diferente dependiendo de la sustancia de que estemos hablando.
Utilidad del Mol
La utilidad de este concepto de mol radica en que cuando consideramos reacciones químicas, las relaciones de masa de las sustancias reaccionantes quedan reducidas a números enteros que corresponden a la fórmula mínima.
Por ejemplo, podemos decir que 4 gramos de hidrógeno gaseoso reaccionan con 32 gramos de oxígeno gaseoso para formar 36 gramos de agua, esto es, reaccionan en una relación de 4:32 o 1:8, lo cual no concuerda muy bien con la fórmula molecular del agua (H2O). Si utilizamos "moles", podemos decir que 2 "moles" de hidrógeno reaccionan con 1 "mol" de oxígeno para formar un "mol" de agua. Esto concuerda mejor con la fórmula molecular del agua, y se justifica mediante medidas volumétricas realizadas a lo largo de la reacción entre ambos gases.
En el laboratorio o en la industria no se trabaja con símbolos o números, se trabaja con sustancias concretas, que se palpan. Para facilitar las tareas de investigación sobre algún elemento químico los científicos utilizan siempre gran cantidad de átomos.
II. Masa molar
La masa molar (símbolo M) de una sustancia dada es una propiedad física definida como su masa por unidad de cantidad de sustancia. Su unidad de medida en el SI es kilogramo por mol (kg/mol o kg·mol-1), sin embargo, por razones históricas, la masa molar es expresada casi siempre en gramos por mol (g/mol).
Las sustancias puras, sean estas elementos o compuestos, poseen una masa molar intensiva y característica. Por ejemplo, la masa molar aproximada del agua es: M (H2O) ≈ 18 g·mol-1.
La masa molar de los átomos de un elemento está dado por el peso atómico de cada elemento multiplicado por la constante de masa molar, Mu = 1×10-3 kg/mol = 1 g/mol. Su valor numérico coincide con el de la masa molecular, pero expresado en gramos/mol en lugar de unidades de masa atómica (u), y se diferencia de ella en que mientras la masa molecular alude una sola molécula, la masa molar corresponde a un mol (6,022×1023) de moléculas.
Ejemplos: M (H) = 1,007 97(7) u × 1 g/mol = 1,007 97(7) g/mol
M(S) = 32,065(5) u × 1 g/mol = 32,065(5) g/mol
M (Cl) = 35,453(2) u × 1 g/mol = 35,453(2) g/mol
M (Fe) = 55,845(2) u × 1 g/mol = 55,845(2) g/mol
La multiplicación por la constante de masa molar asegura que el cálculo es dimensionalmente correcto: los pesos atómicos son cantidades adimensionales (i. e. números puros, sin unidades) mientras que las masas molares tienen asociada una unidad asociada a una magnitud física (en este caso, g/mol).
Usualmente algunos elementos son encontrados en forma molecular, como el hidrógeno (H2), azufre (S8), cloro (Cl2), etc. La masa molar de las moléculas homonucleares es el número de átomos en cada molécula multiplicado por el peso atómico del elemento constante, multiplicado por la constante de masa molar (Mu).
III. Volumen molar
El volumen molar de una sustancia, simbolizado Vm, es el volumen de un mol de ésta. La unidad del Sistema Internacional de Unidades es el metro cúbico por mol: m3 · mol-1
Un mol de cualquier sustancia contiene 6,022 · 1023 partículas. En el caso de sustancias gaseosas moleculares un mol contiene NA moléculas. De aquí resulta, teniendo en cuenta la ley de Avogadro, que un mol de cualquier sustancia gaseosa ocupará siempre el mismo volumen (medido en las mismas condiciones de presión y temperatura). Experimentalmente, se ha podido comprobar que el volumen que ocupa un mol de cualquier gas ideal en condiciones normales (Presión = 1 atmósfera, Temperatura = 273,15 K = 0 °C) es de 22,4 litros. Este valor se conoce como volumen molar normal de un gas. Este valor del volumen molar corresponde a los llamados gases ideales o perfectos; los gases ordinarios no son perfectos (sus moléculas tienen un cierto volumen, aunque sea pequeño) y su volumen molar se aparta ligeramente de este valor. Así los volúmenes molares de algunos gases son:
-
Monóxido de carbono (CO) = 22,4 L.
-
Dióxido de azufre (SO2) = 21,9 L.
-
Dióxido de carbono (CO2) = 22,3 L.
En el caso de sustancias en estado sólido o líquido el volumen molar es mucho menor y distinto para cada sustancia. Por ejemplo:
-
Para el nitrógeno líquido (–210 °C) el volumen molar es de 34,6 cm3.
-
Para el agua líquida (4 °C) el volumen molar es de 18,0 cm3.
Sistema de Nomenclatura según la IUPAC
La función principal de la nomenclatura química es asegurar que la persona que oiga o lea un nombre químico no albergue ninguna duda sobre el compuesto químico en cuestión, es decir, cada nombre debería referirse a una sola sustancia. Se considera menos importante asegurar que cada sustancia tenga un solo nombre, aunque el número de nombres aceptables es limitado.
Nomenclatura sistemática o IUPAC
También llamada racional o estequiometria. Se basa en nombrar a las sustancias usando prefijos numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula. La atomicidad indica el número de átomos de un mismo elemento en una molécula, como por ejemplo el agua con fórmula H2O, que significa que hay un átomo de oxígeno y dos átomos de hidrógeno presentes en cada molécula de este compuesto, aunque de manera más práctica, la atomicidad en una fórmula química también se refiere a la proporción de cada elemento en una cantidad determinada de sustancia. En este estudio sobre nomenclatura química es más conveniente considerar a la atomicidad como el número de átomos de un elemento en una sola molécula. La forma de nombrar los compuestos en este sistema es: prefijo-nombre genérico + prefijo-nombre específico
Prefijos griegos número de átomos
Mono-1
Di- 2
Tri- 3
tetra- 4
Penta-5
Hexa-6
Hepta-7
Oct-8
non- nona- eneá- 9
deca- 10
Por ejemplo, CrBr3 = tribromuro de cromo; CO = monóxido de carbono
En casos en los que puede haber confusión con otros compuestos (sales dobles y triples, oxisales y similares) se pueden emplear los prefijos bis-, tris-, tetras-, etc.
Por ejemplo la fluorapatita Ca5F (PO4)3 = fluoruro tris (fosfato) de calcio, ya que si se usara el término trifosfato se estaría hablando del anión trifosfato [P3O10]5-, en cuyo caso sería:
Ca5F (P3O10)3
Sistema Stock
Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos la valencia atómica del elemento con “nombre específico”. La valencia (o número de oxidación) es el que indica el número de electrones que un átomo pone en juego en un enlace químico, un número positivo cuando tiende a ceder los electrones y un número negativo cuando tiende a ganar electrones. De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico + de + nombre del elemento específico + el No. de valencia. Normalmente, a menos que se haya simplificado la fórmula, la valencia puede verse en el subíndice del otro elemento (en compuestos binarios y ternarios). Los números de valencia normalmente se colocan como superíndices del átomo (elemento) en una fórmula molecular.
mapas conceptuales
Reacciones Químicas

balanceo de la ecuaciones redox

los compuestos inorganicos
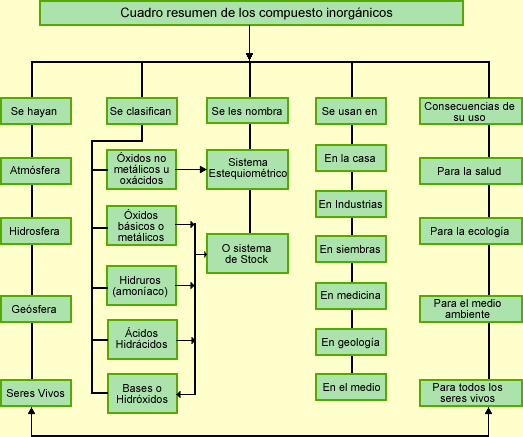
Sistema de Nomenclatura según la IUPAC
