League of Chemistry
Vocabularios
Palabras de los temas dados en el primer trimestre.
1. Anión: ión con carga negativa, esto es en el que un átomo o grupo de átomos tienen más electrones que protones. Este término permite referirse al átomo (o al conjunto de ellos) que obtiene carga eléctrica a partir de ganar o perder una cierta cantidad de electrones.
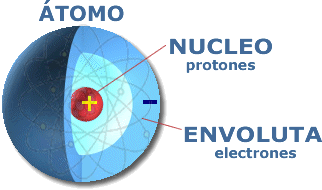
2. Átomo: La partícula más pequeña de un elemento que conserva su identidad química en todos los cambios físicos y químicos. El origen de la palabra átomo proviene del griego, que significa indivisible, los átomos están formados por partículas aún más pequeñas, las partículas subatómicas.
3. Catión: Ión con carga positiva, esto es un ión en el cual el átomo o grupo de átomos tiene menos electrones que protones. El catión es una partícula que forma parte de la materia común con propiedades químicas o como las moléculas que configuran un procedimiento permanente y eléctricamente neutro. Los cationes se especifican como un estado de oxidación positivo que se da cuando un elemento entra en contacto con el oxígeno, esto sucede con los componentes metálicos expuestos al roce con oxígeno y agua.
4. Electrón: partícula subatómica que posee una masa de 0.00054858 uma y carga de -1. Un electrón es una partícula elemental estable cargada negativamente que constituye uno de los componentes fundamentales del átomo. Forma parte del grupo de los leptones.
5. Enlace iónico: Atracción de iones con carga opuesta(cationes y aniones), en gran número para formar un sólido. Los iones resultan de la transferencia de uno o más electrones de un átomo o grupo de átomos a otros.
6. Enlace covalente: enlace químico que se forma cuando se comparte uno o más pares de electrones entre dos átomos.
7. Enlace polar: Enlace covalente entre dos átomos con electronegatividad diferente de mdoo que la densidad electrónica quede distribuída de forma asimétrica.
8. Enlace no polar: Enlace covalente entre dos átomos de igual electronegatividad de modo que la densidad electrónica esté distribuída en forma simétrica.
9. Enlace covalente coordinado: Enlace covalente en el que una especie proporciona el par de electrones compartidos. Enlace entre un ácido y una base de Lewis.
10. Enlace metálico: Enlace de los metales debido a la atracción eléctrica de iones metálicos con carga positiva por los electrones móviles que pertenecen al cristal en su conjunto.
11. Enlace químico: Fuerza de atracción que mantiene unidos a los átomos en elementos y compuestos.
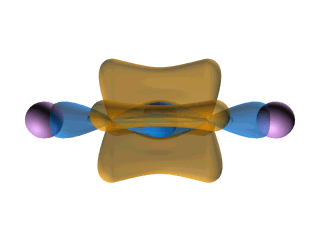
12. Enlace sigma (σ) : Enlace que resulta cuando un orbital molecular sigma está ocupado por electrones; enlace que se forma por superposición frontal de orbitales atómicos.
13. Enlace doble: Enlace covalente que resulta de compartir cuatro electrones (dos pares) entre dos átomos.
14. Enlace triple: Enlace covalente que resulta cuando dos átomos comparten seis electrones (tres pares) entre dos átomos.
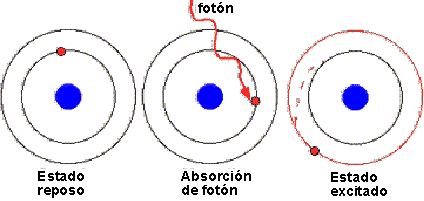
15. Estado excitado: Todo estado energía diferente del estado fundamental de un átomo, ión o molécula.
16. Estado fundamental (basal): Estado de energía más bajo o estado más estable de un átomo, molécula o ión.
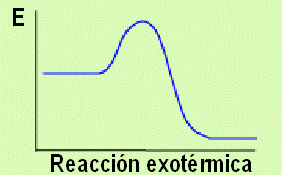
17. Exotérmico: Describe procesos que libera energía calorífica.
18. Fenol: Derivado de un hidrocarburo aromático que tiene un grupo.
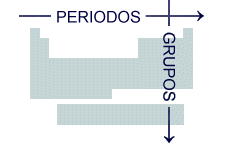
19. Grupo: Columna vertical de la tabla periódica; también se llama familia.
20. Grupo electrónico: Grupo de electrones de valencia que determina la energía electrónica de un átomo central, puede ser un enlace sencillo, doble o uno triple o un par no compartido.
21. Geometría molecular: distribución de los átomos (no de pares de electrones no compartidos )entorno del átomo central de una molécula o ión poliatómico.
22. Geometría electrónica: Distribución geométrica de enlace y pares no compartidos(pares solitarios) entorno al átomo central de una de molécula o ión poliatómico. Esta distribución reduce al mínimo la repulsión entre los grupos de electrones. Cada geometría electrónica comprende una hibridación en particular del átomo central.
23. Gases nobles: (raros) elementos del grupo VIIIA de la tabla periódica. Primero se le dio el nombre de gases inertes He, Ne, Ar, Kr, Xe y Rn .
24. Halógenos: elementos del grupo VIIA de la tabla periódica; F, Cl, Br, I, At. Los elementos existen como moléculas diatómicas.
25. Ión: Átomo o un grupo de átomos con carga eléctrica. Un ión positivo es un catión, un ión negativo es un anión.
26. Materia: Todo lo que tiene masa y ocupa espacio
27. Metal alcalino: Elementos del grupo IA de la tabla periódica, excepto el hidrógeno.
28. Metales alcalinotérreos: Metales del IIA de la tabla periódica.
29. Mezcla: Muestra de materia que se compone de cantidades variables de dos o más sustancias que conserva su identidad y propiedades.
30. Núcleo: Centro de un átomo muy pequeño, muy denso con carga positiva que contiene protones y neutrones excepto el hidrógeno.
31. Número atómico(z): Número entero de protones del núcleo de un átomo; define la identidad de un elemento.
32. Número de oxidación: Número arbitrario que sirve de ayuda mecánica en la escritura de fórmulas y balanceo de ecuaciones para iones de un solo átomo corresponde a la carga del ión; a los átomos menos metálicos se les asigna número de oxidación negativos en compuestos y iones poliatómicos.
33. Número cuántico: Número que describe la energía de electrones en los átomos se deriva del tratamiento mecánico cuántico.
34. Número de Avogadro: 6 022 x 1023 unidades de una especie especificada.
35. Partícula alfa (α): Partícula que se compone de dos protones y dos neutrones; idéntica a un núcleo de Helio.
36. Partícula beta (β ): electrón que emite el núcleo atómico cuando un neutrón decae en un protón y un electrón.
37. Periodicidad: variaciones periódicas regulares de las propiedades de los elementos con el número atómico y posición de la tabla periódica.
38. Peso: Medida de la atracción gravitacional que la tierra ejerce sobre un cuerpo.
39. Peso atómico(PA): Peso promedio de las masas de los isótopos componentes de un elemento; masa relativa de átomos de elementos diferentes.
40. Radiactividad: Decaimiento espontáneo de núcleos atómicos.
41. Radiación: Partícula rayos de alta energía que son emitidos en el proceso decaimiento nuclear.