League of Chemistry
Apuntes Teoricos
III Trimestre
I.- Utilización de fórmulas químicas para determinaciones matemáticas
A.- Procedimientos matemáticos a partir de las fórmulas químicas
A.1.- Cálculos utilizando el mol
Llamamos mol a la cantidad de materia que contiene el Número de Avogadro de partículas elementales. Este número es 6.022x1023. Si ese tipo de materia es un elemento químico, las partículas serán átomos; en caso de que se trate de un compuesto, las partículas elementales serán moléculas.
En Química, las cantidades las medimos en moles para todas las operaciones que queramos realizar: cálculos en reacciones, cálculos en disoluciones, en procesos de neutralización ácido-base, etc. Por ello, el concepto de mol es uno de los fundamentales en Química, ya que lo usamos para casi todo.
El problema para medir moles reside en su propio concepto: no podemos tomar un mol de una sustancia a base de contar átomos por la inmensidad del Número de Avogadro y el hecho de que es imposible "coger" un átomo. Por eso, en el laboratorio o para realizar cálculos necesitamos encontrar una relación entre el mol y otra magnitud más fácil de medir: la masa. Así podemos medir moles usando una balanza. Y esta relación es bien sencilla: en un mol de una sustancia hay tantos gramos como uma (unidad de masa atómica) hay en la masa de la molécula o del átomo, dependiendo si es un compuesto o un elemento. Es decir, la masa molecular del agua es 18 uma, por consiguiente, un mol de agua tiene una masa de 18 gramos.
Además, para los gases, podemos afirmar que un mol de cualquier gas ocupa 22,4 litros en condiciones normales, 0° centígrados y 1 atmósfera de presión. Este volumen se llama VOLUMEN MOLAR NORMAL.
A.2. Cálculos utilizando la masa molar
La noción de masa molar refiere a la masa de un mol de una cierta sustancia, expresada en gramos. Un mol, por su parte, es la cantidad de sustancia que contiene tantas entidades elementales (átomos, moléculas, iones, etc.) de un tipo como átomos presentes en 12 gramos de carbono-12.
La cantidad de unidades elementales que indica un mol de sustancia, por lo tanto, es constante, ya que no depende del tipo de material o de partícula. A esa cantidad se la conoce como número de Avogadro. Esta constante permite que los químicos expresen el peso de los átomos. La ecuación indica que un mol equivale a 6,022 x 10 elevado a 23 partículas.
La masa molar, en definitiva, expresa la masa de un mol en gramos. Si la masa molecular de una sustancia en uma es p, la masa molar de dicha sustancia también será p, pero expresada en gramos.
Para calcular la masa molar, hay que recurrir a la tabla periódica de elementos. Si tomamos el caso del agua (H2O), veremos que una molécula está compuesta por dos átomos de hidrógeno y un átomo de oxígeno. La masa atómica del hidrógeno, quitando decimales, es 1 uma y la del oxígeno, 16 uma. Al sumar estos datos de los dos átomos de hidrógeno y el átomo de oxígeno, obtenemos una masa molecular de 18 gramos. La masa molar del agua, por lo tanto, también es de 18 gramos.
El peso molecular (abreviado como P.M.) es como antiguamente se denominaba a la masa molar relativa, el nombre que recibe actualmente. Se trata de una magnitud adimensional (que no está asociada a una dimensión física) igual al resultado de dividir la masa molar por la constante de masa molar, la cual relaciona la masa molar y el peso atómico. Técnicamente, la masa molar relativa se desprende de medir la masa molar en una escala en la cual el valor de un átomo no enlazado de carbono-12, en su estado fundamental y en reposo sea 12.
No se debe incurrir en el error de pensar que el peso molecular y la masa molar son conceptos equivalentes; su similitud en cuanto a los valores numéricos es aprovechada por cuestiones de comodidad a la hora de realizar cálculos, pero en ningún caso son datos intercambiables.
Cada sustancia tiene una única masa molar, la cual es igual numéricamente a su masa atómica, aunque esta última se expresa en uma, y esta información se encuentra en la tabla periódica. La razón de que cada elemento tenga una masa molar diferente es que sus átomos poseen un número diferente de electrones, protones y neutrones, lo cual repercute en sus masas atómicas.
Es importante entender que el número que representa un mol es muy grande; por ejemplo, si bien una docena de manzanas podrían ser ideales para que doce personas comieran fruta después del almuerzo, un mol de manzanas tiene un volumen aproximado de 30 millones el de todos los océanos de nuestro planeta.
En química, el uso del mol está destinado a calcular el número de moléculas y átomos que hay en una sustancia determinada, dado que se trata de elementos de un tamaño extremadamente pequeño. En tan sólo una gota de agua hay tantas moléculas de H2O que la mayoría de la gente no sabría cómo expresar la cantidad, y es por eso que el concepto de mol resulta tan útil en estos casos, para evitar las magnitudes con millones, billones, trillones, etcétera.
A.3. Cálculos utilizando el volumen molar
Como se puede advertir si analizamos la definición que mencionamos en el primer párrafo, para entender qué es el volumen molar se hace imprescindible comprender qué es el volumen y qué es un mol.
La idea de volumen puede usarse de distintos modos: en este caso, nos interesa su acepción como la magnitud que señala el espacio ocupado por algo en alto, ancho y largo (es decir, en tres dimensiones). Un mol, por su parte, es una unidad que permite realizar la medición de la cantidad existente de un elemento que tiene un peso equivalente a su peso molecular reflejado en gramos.
Es importante mencionar que, en toda sustancia, un mol alberga una cantidad de masa que está contenida en 6,022 x 10 elevado a 23 moléculas. Esta cifra (6,022 x 10 elevado a 23) se denomina número de Avogadro y es la cantidad de átomos existente en doce gramos de carbono-12 puro. El número de Avogadro permite contabilizar entidades microscópicas partiendo de medidas microscópicas.
También es necesario conocer la ley de Avogadro, que señala que, cuando distintos gases se miden en idénticas condiciones de temperatura y presión, albergan la misma cantidad de partículas.
Retomando la idea de volumen molecular, a partir de lo mencionado por la ley de Avogadro, se desprende que el mol de un gas siempre ocupa el mismo volumen cuando se mantienen las condiciones de temperatura y presión. El volumen molar normal de las sustancias gaseosas es 22,4 litros, estimado con una temperatura de 0º C y una presión de 1 atmósfera.
A.4. Cálculos utilizando el número de Avogadro
El número de Avogadro es la cantidad de átomos, electrones, iones, moléculas que se encuentran en un mol, además este número sirve para establecer conversiones entre el gramo y la unidad de masa atómica.
La equivalencia del número de Avogadro es enorme, más o menos equivale al volumen de la luna dividido en bolas de 1 milímetro de radio.
El valor del número de Avogadro se halla a partir de la definición del número de átomos de carbono contenidos en 12 gramos de carbono-12 elevado a la potencia 23.
Ya en el año 2006, el Comité de Información para Ciencia y Tecnología recomendó que el valor del número de Avogrado sea el siguiente:
Donde:
(30) es la incertidumbre estándar de la constante, concretamente al valor 0.000 000
30×1023 mol−1.
El número de Avogadro recibe ese nombre por el científico italiano Amedeo Avogadro, quien, dijo que el volumen de un gas es proporcional al número de átomos, o moléculas.
El valor del número de Avogadro donde se dice que equivale al diámetro medio de las moléculas en el aire por un método equivalente, fue propuesto por Johann Josef Loschmidt.
El número de moléculas en una molécula-gramo de oxígeno que para ser más exactos equivale a 32 gramos de oxígeno, es otra explicación que se tiene para definir el número de Avogadro, pero este número ya no es un número puro, sino es considerado más bien como una magnitud física.
También se puede definir el número de Avogadro en unidades como la libra-mol (lb-mol.) y el onza-mol (oz -mol.).
Por otra parte, el número de Avogadro, da la posibilidad de poder establecer conversiones entre el gramo y la unidad de masa atómica.
En resumen el número de Avogadro es el número de átomos o moléculas que existen en un mol de un elemento o compuesto, siendo su valor equivalente a 6.023×10(23) moléculas/mol. Para representarlo se usa el símbolo NA:
NA = 6.023·10(23) moléculas/mol
B.- Utilización de fórmulas químicas para la determinación del Porcentaje de composición de una sustancia
B.1. Determinación de la Fórmula empírica
La fórmula empírica es la fórmula que expresa la relación más simple entre sus átomos constituyentes y, por tanto, no es la verdadera fórmula del compuesto, pero a partir de ella es posible obtener la fórmula molecular o verdadera fórmula del compuesto. La determinación de la fórmula empírica se realiza a partir de datos obtenidos mediante análisis químico. Consideremos, por ejemplo, los resultados obtenidos mediante análisis químico para un compuesto desconocido.
-
masa de carbono = 0,8180 g, masa de hidrógeno = 0,1370 g y masa de oxígeno = 0,5450 g.
Las etapas que debemos de seguir para encontrar la fórmula empírica a partir de estos datos son:
1. Determinamos la cantidad (de acuerdo con SI el término cantidad se refiere a mol) de cada elemento constituyente del compuesto.
-
mol de C = masa de carbono/Masa atómica del carbono = 0,8180 g/12,011 gmol-1 = 0,06810
-
mol de H = masa de hidrógeno/Masa atómica del hidrógeno = 0,1370 g/1,0079 gmol-1 = 0,1359
-
mol de oxígeno = masa de oxígeno/Masa atómica del oxígeno = 0,5450 g/15,9994 gmol-1 = 0,03406
2. Determinamos la relación más simple. Esto lo podemos hacer dividiendo el menor entre el menor y todos entre el menor.
-
relación mol de C/mol de oxígeno = 0,06810/0,03406=1,999 aproximado a 2
-
relación mol de H/mol de oxígeno = 0,1359/0,03406 = 3,990 aproximado a 4
-
relación mol de O/mol de oxígeno = 0,03406/0,03406 = 1,000 ó 1
3. Determinamos la fórmula empírica.
-
C2H4O
Nota: Si los resultados del análisis químico se reportan en composición centesimal o en porcentaje, podemos aplicar el mismo procedimiento anterior, pero la cantidad es referida a 100 g de muestra. Al obtener la relación más simple y al estar todas las cantidades, referidas a 100 g de muestra ésta se cancela, obteniéndose el mismo resultado:
-
mol de A/ 100 g de muestra = %A/ Masa atómica de A
-
mol de B/100 g de muestra = %B/Masa atómica de B
-
mol de C/100 g de muestra = %C/Masa atómica de C
Relación más simple : Asumiendo la primera como la menor cantidad,
-
(mol de B/100 g de muestra)/(mol de A/100 g de muestra) = mol de B/mol de A
-
(mol de C/100 g de muestra)/(mol de A/100 g de muestra) = mol de C/mol de A
-
(mol de A/ 100 g de muestra)/(mol de A/100 g de muestra) = 1
B.2. Determinación de la fórmula verdadera
La fórmula molecular es la verdadera fórmula de una sustancia compuesta y, por tanto, nos indica la relación real entre los átomos que constituyen a la molécula de la sustancia compuesta.
La fórmula molecular puede ser determinada utilizando métodos instrumentales como, por ejemplo, espectrometría de masas, resonancia magnética del protón, espectroscopia infrarrojo, UV, difracción de rayos X o la combinación de varias de ellas, pero también se pueden utilizar métodos clásicos de análisis como volumetría o gravimetría.
Para determinar la fórmula molecular a partir de la composición centesimal de una sustancia, es requerido:
-
Conocimiento de la composición centesimal o composición porcentual
-
Conocimiento de la masa molar que se puede determinar mediante espectrometría de masas, propiedades coligativas (ebulloscopía, crioscopía, osmometría y descenso en la presión de vapor), método de Jean Dumas, Victor Meyer, densidades límites y otros.
-
Conocimiento de las masas atómicas o masas molares de los elementos que forman la fórmula.
-
Se puede utilizar la fórmula empírica, pero no es prescindible.
Por ejemplo, para una sustancia hipotética de fórmula AxByCz, los subíndices x, y, z, se determinan aplicando las siguientes expresiones:
x = (% de A . Mm del compuesto)/(100 . Mm de A)
y = (% de B . Mm del compuesto)/100 . Mm de B)
z = (% de C . Mm del compuesto)/(100 . Mm de C)




La figura muestra un ejemplo de un espectro de rsonancia magnética nuclear del protón
II. Sucesos en que ocurren reacciones químicas
A.1. Durante la síntesis o composición de sustancias
El análisis químico de las sustancias orgánicas que todas ellas contienen el elemento carbono acompañado de hidrógeno.
En las sustancias que forman los seres vivos (hidratos de carbono, lípidos, proteínas, ácidos nucléicos) sus componentes fundamentales son el carbono, el hidrógeno, el oxígeno y frecuentemente el nitrógeno (C, H,O, N). Por eso, estos cuatro elementos fueron denominados biogenésicos. Otros elementos que se encuentran en mucha menor proporción son el azufre y el fósforo, y en pequeñísimas cantidades halógenos (cloro, yodo) y metales (calcio, magnesio, sodio, potasio, hierro, cobre, cinc, cobalto, manganeso, etcétera).
En el petróleo y en el gas natural, que son mezclas de hidrocarburos se encuentra carbono y hidrógeno, y en muy pequeñas proporciones oxígeno, azufre y nitrógeno.
Las moléculas orgánicas, generalmente, están formadas por muchos átomos de pocos elementos. La mayoría son complejas (proteínas, glúcidos, ácidos nucléicos, vitaminas, medicamentos, etcétera) aunque también existen otras sencillas (metano, etano, etanol, ácido acético, etcétera).
A.2. Durante la descomposición o análisis de sustancias
Análisis químico, conjunto de técnicas y procedimientos empleados para identificar y cuantificar la composición química de una sustancia. En un análisis cualitativo se pretende identificar las sustancias de una muestra. En el análisis cuantitativo lo que se busca es determinar la cantidad o concentración en que se encuentra una sustancia específica en una muestra. Por ejemplo, averiguar si una muestra de sal contiene el elemento yodo sería un análisis cualitativo, y medir el porcentaje en masa de yodo de esa muestra constituiría un análisis cuantitativo. Un análisis efectivo de una muestra suele basarse en una reacción química del componente, que produce una cualidad fácilmente identificable, como color, calor o insolubilidad. Los análisis gravimétricos basados en la medición de la masa de precipitados del componente, y los análisis volumétricos, que dependen de la medición de volúmenes de disoluciones que reaccionan con el componente, se conocen como ‘métodos por vía húmeda’, y resultan más laboriosos y menos versátiles que los métodos más modernos. Los métodos instrumentales de análisis basados en instrumentos electrónicos cobraron gran importancia en la década de 1950, y hoy la mayoría de las técnicas analíticas se apoyan en estos equipos. La determinación de la composición química de una sustancia es fundamental en el comercio, en las legislaciones y en muchos campos de la ciencia. Por ello, el análisis químico se diversifica en numerosas formas especializadas. Preparación para el análisis Frecuentemente la tarea de los químicos consiste en analizar materiales tan diversos como acero inoxidable, cerveza, uñas, pétalos de rosa, humo, medicamentos o papel. Para determinar la identidad o cantidad de un elemento de estos materiales, se procede en primer lugar a la toma de la muestra, lo que implica la selección de cantidad y grado de uniformidad de material requeridos para el análisis (además de homogénea, la muestra debe ser representativa). A continuación se separan de la muestra los componentes deseados o aquéllos que puedan interferir en el estudio. El método de separación idóneo dependerá de la naturaleza del componente a analizar y de la muestra en sí. La separación se basa en la posibilidad de utilizar las diferencias existentes en las propiedades físicas y químicas de los componentes. Así, en una mezcla simple de sal y arena es fácil extraer la sal, pues ésta es soluble en agua, mientras que la arena no lo es. En el caso de una mezcla de arena y partículas de hierro, ninguna de las dos partes es soluble en agua, pero el hierro tiene propiedades magnéticas y la arena no. La cromatografía es el método de separación más usual y tiene varias modalidades dependiendo de la naturaleza de la columna cromatográfica y de la interacción de los componentes de la muestra. Las dos formas más importantes son la cromatografía por filtración de geles, en la que grandes moléculas se separan según su tamaño, y la cromatografía por intercambio iónico, donde se separan los componentes iónicos. En la cromatografía en fase gaseosa son los componentes volátiles los que se separan de la muestra, y en la cromatografía en fase líquida, las pequeñas moléculas neutras de una disolución. El objeto de la separación es obtener el componente deseado en forma pura, o parcialmente pura, para su determinación analítica, o eliminar otros componentes cuya presencia obstaculizaría la medición, o ambas cosas a la vez. En general, la separación es innecesaria cuando el método de análisis resulta específico o selectivo y responde al componente deseado, ignorando los demás. Por ejemplo, para medir el pH de la sangre con un electrodo de vidrio, no es necesario un proceso previo de separación. Otro proceso previo para el análisis cualitativo y cuantitativo es la calibración. La respuesta del método analítico y la sensibilidad del equipo mecánico y electrónico empleado respecto al componente deseado debe calibrarse usando un componente puro o una muestra que contenga una cantidad conocida de ese componente.Presentación y veracidad de los resultados El resultado numérico de un análisis cuantitativo puede establecer la cantidad absoluta del componente o un porcentaje de éste en la muestra. En este último caso puede expresarse como porcentaje en masa, concentración molar (moles de un componente disuelto por litro de disolución) o como ppm (partes por millón en masa). La exactitud de los resultados del análisis queda reflejada en el grado de concordancia con la cantidad real del elemento. La precisión de los resultados la dará la posibilidad de repetir y reproducir el análisis. Los resultados son precisos cuando son fruto de mediciones repetidas y se dan en un estrecho margen de valores. Estos resultados se dice que son altamente reproducibles. La precisión no significa que los resultados sean exactos, ya que parte de los procedimientos de medición pueden desviarlos hacia valores más altos o más bajos que el valor real. A menudo la repetición del análisis encubre estos errores sistemáticos.Los errores aleatorios tienden a corregirse entre ellos. La exactitud se suele lograr teniendo en cuenta la media de múltiples factores. Según el método empleado, puede ser necesario repetir las mediciones sólo tres o cuatro veces. Cuando en un proceso se conectan ordenadores o computadoras a los instrumentos analíticos, las mediciones se pueden repetir hasta 100.000 veces a gran velocidad; a esta técnica se la denomina señal promedio.
A.3. Durante el desplazamiento o sustitución simple de sustancias
En una reacción de simple desplazamiento un elemento reacciona con un compuesto y toma el lugar de uno de los elementos del compuesto, produciendo un elemento distinto y un compuesto también diferente. La fórmula general de esta ecuación es:
Si A es un metal, remplaza a B para formar AC, siempre y cuando A sea más reactivo que B. Si A es un halógeno, reemplaza a C para formar BA, siempre y cuando A sea un halógeno más reactivo que C.
En la tabla que aparece en el lado derecho vemos una serie de actividad de algunos metales y elhidrógeno, así como de halógenos. Esta serie esta en orden decreciente de reactividad química. Los metales y los halógenos más activos están arriba. Con esa serie es posible predecir muchas reacciones químicas.
Una de las reacciones químicas comunes es el desplazamiento del hidrógeno del agua o de los ácidos. Esta reacción es un buen ejemplo de la reactividad de los metales y del uso de la serie de actividades. Así:
-
El K, el Ca y el Na desplazan al hidrógeno del agua fría, vapor y ácidos.
-
El Mg, el Al, el Zn y el Fe desplazan al hidrógeno del vapor y los ácidos.
-
El Ni, el Sn y el Pb desplazan al hidrógeno sólo de los ácidos.
-
El Cu, la Ag, el Hg y el Au no desplazan al hidrógeno.
Por ejemplo, el magnesio metálico reemplaza al hidrógeno de una solución de ácido clorhídrico. Pero el cobre metálico, que está abajo del hidrógeno en la lista y por lo tanto es menos reactivo, no reemplaza al hidrógeno del ácido clorhídrico. A continuación aparece la ecuación de la reacción entre el magnesio metálico y el ácido clorhídrico acuoso para formar cloruro de magnesio y gas hidrógeno:
Un metal muy activo, como el sodio, puede desplazar al gas hidrógeno del agua. En este tipo, solamente uno de los átomos de hidrógeno es desplazado, debido a la pequeña cantidad de H+ formado a partir de la molécula de H-OH.
Hay reacciones de simple desplazamiento en las cuales toman parte los no metales. Por ejemplo, para los halógenos, la serie será: flúor, cloro, bromo, yodo, así es que el cloro libre desplazará al bromo de un compuesto y el bromo desplazará al yodo de un compuesto. Observe que la actividad de los no metales está relacionada con su habilidad de ganar electrones y formar iones negativos, mientras que la actividad de los metales está relacionada con su tendencia a perder electrones para formar iones positivos. Cuando se escriben reacciones de simple desplazamiento en donde participan los halógenos, tenga en cuenta que en estado libre todos los halógenos existen como moléculas diatómicas.
A.4. Durante el doble desplazamiento o intercambio de sustancias
También llamada de doble descomposición o metátesis, es una reacción entre dos compuestos que generalmente están cada uno en solución acuosa. Consiste en que dos elementos que se encuentran en compuestos diferentes intercambian posiciones, formando dos nuevos compuestos. Estas reacciones químicas no presentan cambios en el numero de oxidación o carga relativa de los elementos, por lo cual también se le denominan reacciones NO – REDOX.
Ejemplos:
En reacciones de precipitación se producen sustancias parcialmente solubles o insolubles, los cuales van al fondo del recipiente donde se realiza la reacción química. Los precipitados por lo general presentan colores típicos, razón por la cual son usados en química analítica para reconocimiento de elementos y compuestos.
A.5. Durante la neutralización de sustancias
Las reacciones de neutralización, son las reacciones entre un ácido y una base, con el fin de determinar la concentración de las distintas sustancias en la disolución.
Tienen lugar cuando un ácido reacciona totalmente con una base, produciendo sal y agua. Sólo hay un único caso donde no se forma agua en la reacción, se trata de la combinación de óxido de un no metal, con un óxido de un metal.
Ácido + base → sal + agua
Por ejemplo: HCl + NaOH → NaCl + H2O
Las soluciones acuosas son buenas conductoras de la energía eléctrica, debido a los electrolitos, que son los iones positivos y negativos de los compuestos que se encuentran presentes en la solución.
Una buena manera de medir la conductancia es estudiar el movimiento de los iones en una solución.
Cuando un compuesto iónico se disocia enteramente, se le conoce como electrolito fuerte. Son electrolitos fuertes por ejemplo el NaCl, HCl, H2O (potable), etc, en cambio, un electrolito débil es aquel que se disocia muy poco, no produciendo la cantidad suficiente de concentración de iones, por lo que no puede ser conductor de la corriente eléctrica.
Cuando tenemos una disolución con una cantidad de ácido desconocida, dicha cantidad se puede hallar añadiendo poco a poco una base, haciendo que se neutralice la disolución.
Una vez que la disolución ya esté neutralizada, como conocemos la cantidad de base que hemos añadido, se hace fácil determinar la cantidad de ácido que había en la disolución.
En todos los procesos de neutralización se cumple con la “ley de equivalentes”, donde el número de equivalentes del ácido debe ser igual al número de equivalentes de la base:
Nº equivalentes Ácido = nº equivalentes Base
Los equivalentes dependen de la Normalidad, que es la forma de medir las concentraciones de un soluto en un disolvente, así tenemos que:
N= nº de equivalentes de soluto / litros de disolución
Deduciendo : nº equivalentes de soluto = V disolución . Normalidad
Si denominamos NA, como la normalidad en la solución ácida y NB, la normalidad de la solución básica, así como VA y VB, como el volumen de las soluciones ácidas y básicas respectivamente:
NA.VA= NB. VB
Esta expresión se cumple en todas las reacciones de neutralización. Ésta reacción se usa para la determinar la normalidad de una de las disolución, la ácida o la básica, cuando conocemos la disolución con la que la neutralizamos, añadimos así, poco a poco un volumen sabido de la disolución conocida, sobre la solución a estudiar, conteniendo ésta un indicador para poder así observar los cambios de coloración cuando se produzca la neutralización.
El valor del pH, definido como el – log[H+], cuando los equivalentes del ácido y de la base son iguales, se le conoce como punto de equivalencia. El punto de equivalencia puede ser práctico, o teórico.
En el pH, la escala del 0 al 7, es medio ácido, y del 7 al 14, medio básico, siendo el valor en torno al 7, un pH neutro.
Si valoramos la reacción entre un ácido fuerte y una base fuerte, el punto equivalente teórico estará en torno a 7, produciéndose una total neutralización de la disolución. En cambio, si se estudia un ácido débil con una base fuerte, la sal que se produce se hidrolizará, añadiendo a la disolución iones OH-, por lo tanto el punto de equivalencia será mayor que 7. Y si es el caso de un ácido fuerte con una base débil, la sal que se produce se hidroliza añadiendo los iones hidronios, siendo asñi el punto de equivalencia menos que 7.
Cuanto más cerca se encuentren los valores de los puntos teóricos y prácticos, menor será el error cometido.
A.6. Durante las reacciones de combustión
La reacción de combustión puede llevarse a cabo directamente con el oxigeno o bien con una mezcla de sustancias que contengan oxígeno, llamada comburente, siendo el aire atmosférico el comburente mas habitual.
La reacción del combustible con el oxígeno origina sustancias gaseosas entre las cuales las más comunes son CO2 y H2O. Se denominan en forma genérica productos, humos o gases de combustión. Es importante destacar que el combustible solo reacciona con el oxigeno y no con el nitrógeno, el otro componente del aire. Por lo tanto el nitrógeno del aire pasará íntegramente a los productos de combustión sin reaccionar.
Las reacciones químicas que se utilizan en el estudio de las combustiones técnicas tanto si se emplea aire u oxigeno, son muy sencillas y las principales son:
C + O2 → CO2
CO + 1⁄2 O2 → CO2
H2 + 1⁄2 O2 → H2O
S + O2 → SO2
SH2 + 3⁄2 O2 → SO2 + H2O
Entre las sustancias más comunes que se pueden encontrar en los productos o humos de la reacción se encuentran:
CO2 : Dióxido de Carbono
H2O : Vapor de Agua
N2 : Nitrógeno gaseoso
O2 : Oxigeno gaseoso
CO : Monóxido de Carbono
H2 : Hidrogeno gaseoso
Carbono en forma de hollín
SO2 : Dióxido de Azufre
De acuerdo a como se produzcan las reacciones de combustión, estas pueden ser de distintos tipos:
a) Combustión completa
Ocurre cuando las sustancias combustibles reaccionan hasta el máximo grado posible de oxidación. En este caso no habrá presencia de sustancias combustibles en los productos o humos de la reacción.
b) Combustión incompleta
Se produce cuando no se alcanza el grado máximo de oxidación y hay presencia de sustancias combustibles en los gases o humos de la reacción.
c) Combustión estequiométrica o teórica
Es la combustión que se lleva a cabo con la cantidad mínima de aire para que no existan sustancias combustibles en los gases de reacción. En este tipo de combustión no hay presencia de oxígeno en los humos, debido a que este se ha empleado íntegramente en la reacción.
d) Combustión con exceso de aire
Es la reacción que se produce con una cantidad de aire superior al mínimo necesario. Cuando se utiliza un exceso de aire, la combustión tiende a no producir sustancias combustibles en los gases de reacción. En este tipo de combustión es típica la presencia de oxígeno en los gases de combustión.
La razón por la cual se utiliza normalmente un exceso de aire es hacer reaccionar completamente el combustible disponible en el proceso.
e) Combustión con defecto de aire
Es la reacción que se produce con una menor cantidad de aire que el mínimo necesario. En este tipo de reacción es característica la presencia de sustancias combustibles en los gases o humos de reacción.
Aplicaciones de las reacciones de combustión
Las reacciones de combustión son muy útiles para la industria de procesos ya que permiten disponer de energía para otros usos y generalmente se realizan en equipos de proceso como hornos, calderas y todo tipo de cámaras de combustión.
En estos equipos se utilizan distintas tecnologías y dispositivos para llevar a cabo las reacciones de combustión.
Un dispositivo muy común denominado quemador, produce una llama característica para cada combustible empleado. Este dispositivo debe mezclar el combustible y un agente oxidante (el comburente) en proporciones que se encuentren dentro de los límites de inflamabilidad para el encendido y así lograr una combustión constante. Además debe asegurar el funcionamiento continuo sin permitir una discontinuidad en el sistema de alimentación del combustible o el desplazamiento de la llama a una región de baja temperatura donde se apagaría.
Los quemadores pueden clasificarse en dos tipos, de mezcla previa o premezcla donde el combustible y el oxidante se mezclan antes del encendido y el quemador directo, donde el combustible y el oxidante se mezclan en el punto de ignición o encendido.
También debe tenerse en cuenta para su operación otros parámetros como estabilidad de la llama, retraso de ignición y velocidad de la llama, los cuales deben mantenerse dentro de los límites de operación prefijados.
Para el quemado de combustibles líquidos, en general estos atomizados o vaporizados en el aire de combustión. En los quemadores de vaporización, el calor de la llama convierte continuamente el combustible líquido en vapor en el aire de combustión y así se auto mantiene la llama.
Para el caso de combustibles gaseosos, se utilizan distintos diseños que pueden ser circulares o lineales con orificios, que permiten la salida del gas combustible y un orificio por donde ingresa el aire mediante tiro natural o forzado.
Es importante comprender que como resultado de una combustión, mediante la operación de estos dispositivos, se pueden producir sustancias nocivas y contaminantes, las cuales deberán ser perfectamente controladas, reduciéndolas a concentraciones permitidas o eliminadas, de acuerdo a la legislación vigente sobre el tema.
C. Métodos para realizar el balance de una reacción química
C. 1. El Método de tanteo
Se emplea para balancear ecuaciones sencillas. Se realiza al "cálculo" tratando de igualar ambos miembros. Para ello utilizaremos el siguiente ejemplo:
Balancear:
N2 + H2 NH3
Identificamos las sustancias que intervienen en la reacción. En este caso el nitrógeno y el hidrógeno para obtener amoniaco.
Se verifica si la ecuación está balanceada o no. En este caso notamos que ambos miembros no tienen la misma cantidad de átomos, por lo tanto no está balanceada.
Se balancea la ecuación colocando coeficientes delante de las fórmulas o símbolos que los necesitan. Empezar con los elementos metálicos o por el que se encuentra presente en menos sustancias:
Primero balanceamos el nitrógeno: N2 + H2 2 NH3
El hidrógeno y oxígeno quedarán para el final. Seguidamente balanceamos el hidrógeno:
N2 + 3 H2 2 NH3.
Si un coeficiente no es entero, entonces debe multiplicar todos por el mayor de los denominadores. En este caso no ocurre.
Como es un tanteo, debe recordar que las reglas indicadas, son recomendaciones. Aún así, para cualquier ejercicio, empiece usted, por donde desee pero tomando como parámetro que el número de átomos de este elemento está definido en uno de los miembros.
C. 2. Método algebraico
En Química la base de todo es el balance, pero un balance es el más importante y vital para todo proceso químico, el de sus ecuaciones. Existen múltiples métodos a través de los cuales se puede balancear una ecuación y su uso dependerá del tipo de ecuación que es, si es una Reducción-Oxidación (REDOX) o cualquiera de los otros tipos que existen. El método más usado para balancear una ecuación química es el del método algebraico, el cual se vale de cualquier tipo de brujería u operaciones matemáticas que utilicemos para poder resolver las ecuaciones algebraicas que nos generen cada uno de los elementos que forman los compuestos que a su vez son parte de estas ecuaciones. Estas operaciones matemáticas pueden ir desde sumas hasta resolver complejos y algo trolls sistemas de ecuaciones a través de los cuales cumpliremos nuestro objetivo.
Ya hemos hablado mucho acerca de lo bondadoso que es el uso de este método para balancear ecuaciones químicas, pero ahora vamos como los pollos: al grano. Este método consiste en que veremos la cantidad de compuestos que forman parte de nuestra ecuación química y a cada compuesto le asignaremos una letra del abecedario, por ejemplo supongamos que hay 4 compuestos, entonces podríamos usar las letras A, B, C y D, que no necesariamente tiene que ser en orden alfabético, pero es recomendable. Una vez que hayamos hecho esto procederemos a ver que elementos forman parte de todos estos compuestos, supongamos que tenemos la siguiente ecuación, la cual es de un compuesto que nos hace estar muy salados en muchas ocasiones (mal chiste), la sal de mesa o con su nombre químico el cloruro de sodio.
Para comprender ese punto mejor veamos el caso del Cl2 (Cloro), vemos que el subíndice del Cloro nos indica que hay dos átomos del mismo y esos dos átomos se encuentran en el compuesto al que le asignamos la letra b, entonces para armar nuestra ecuación individual del cloro vamos a colocar 2b = (El igual lo colocamos para denotar que no hay mas átomos de ese elemento en ningún otro compuesto que se encuentre del lado de los reactivos, y que comenzaremos a colocar los átomos de dicho elemento que están del lado de los productos) c, porque del lado de los reactivos en el compuesto que denotamos con la letra C hay un átomo de Cloro (Cl).
Una vez tengamos todas las ecuaciones para cada uno de todos los elementos que formen parte de esta ecuación química, vamos a poder utilizar lo que yo llamaría “El comodín del balanceo” que consiste en darle el valor de “1” a algunas de las variables alfabéticas, que en este caso son A, V y C de manera que al darle dicho valor, utilizando métodos como despeje, sistemas de ecuaciones y demás brujerías matemáticas podamos encontrar el valor que representan cada una de ellas y ese número que fue nuestro resultado será el que colocaremos delante del compuesto que la acompaña, es decir: Si el valor de A = 2 entonces nos fijamos en nuestra ecuación que el compuesto con la letra A es el Na y para armar la ecuación final balanceada pondríamos 2Na. En muchos casos se tiene tendencia a que si el valor de la variable es 1, se obviá en la ecuación y se deja sin nada delante del compuesto. Es decir: Si a = 1, entonces el Sodio quedaría en la ecuación final balanceada como Na.
C.3. Balanceo de las ecuaciones Redox
Se describe el método de balanceo de ecuaciones químicas por oxidación y reducción.
Describiremos el método de balanceo de una ecuación química por el método Redox. Recordemos que el balanceo de una ecuación química no es más que hacer cumplir que el número de de átomos en un lado de la ecuación sea igual al número de átomos del otro lado. Como ejemplo tenemos el caso de la oxidación del hierro con oxigeno para producir ácido férrico, estos es: Fe+O2→Fe2O3.Como se puede observar hay más átomos de hierro a un lado de la ecuación que en el otro lado, así que debe ser balanceada. Para balancear esta ecuación por el método Redox, se deben tener en cuenta las siguientes definiciones: una sustancia se oxida cuando pierde electrones y se reduce cuando gana electrones, así que el balance dependerá del número de oxidación de cada uno de los elementos o compuestos.
Las sustancias que se encuentran puras tienen un estado de oxidación igual a cero, los números de oxidación de las demás sustancias dependerán de su distribución electrónica. Hay valores típicos de número de oxidación para elementos como el hidrógeno y el oxigeno cuando están en una molécula, por lo general son +1 y -2 respectivamente. El método consiste en que se debe buscar que se cumpla la siguiente condición: el número de oxidación tanto a la izquierda como a la derecha de la ecuación debe ser cero. Aplicando este método la ecuación balanceada queda de la siguiente manera: 4Fe+3O2→2Fe2O3
D. Razones molares y reactivo limitante
Sabemos que hay una relación directa entre mol y molécula. Esta relación es el número de Avogadro. Un mol siempre contiene el número de Avogadro de moléculas. Por tanto las relaciones existentes entre moléculas dadas por los coeficientes estequiométricos también son válidas para los moles.
Los coeficientes estequiométricosindican la proporción en la que intervienen los moles de reactivos yproductos en una reacción química.
Cuando en una reacción química se indican las relaciones molares entre productos y reactivos, si puede haber coeficientes estequiométricos fraccionarios, ya que las cantidades de moléculas que intervienen son muy elevadas, y podemos hablar de medio mol de moléculas o de un tercio de mol de moléculas.
E. El rendimiento de una reacción
En química, el rendimiento, también referido como rendimiento químico y rendimiento de reacción, es la cantidad de producto obtenido en una reacción química.1 El rendimiento absoluto puede ser dado como la masa en gramos o en moles (rendimiento molar). El rendimiento fraccional o rendimiento relativo o rendimiento porcentual, que sirve para medir la efectividad de un procedimiento de síntesis, es calculado al dividir la cantidad de producto obtenido en moles por el rendimiento teórico en moles:
Para obtener el rendimiento porcentual, multiplíquese el rendimiento fraccional por 100% (por ejemplo, 0,673 = 67,3%).
Uno o más reactivos en una reacción química suelen ser usados en exceso. El rendimiento teórico es calculado basado en la cantidad molar del reactivo limitante, tomando en cuenta la estequiometría de la reacción. Para el cálculo, se suele asumir que hay una sola reacción involucrada.
El rendimiento teórico o ideal de una reacción química debería ser el 100%, un valor que es imposible alcanzar en la mayoría de puestas experimentales. De acuerdo con Vogel, los rendimientos cercanos al 100% son denominados cuantitativos, los rendimientos sobre el 90% son denominados excelentes, los rendimientos sobre el 80% muy buenos, sobre el 70% son buenos, alrededor del 50% son regulares, y debajo del 40% son pobres.1 Los rendimientos parecen ser superiores al 100% cuando los productos son impuros. Los pasos de purificación siempre disminuyen el rendimiento, y los rendimientos reportados usualmente se refieren al rendimiento del producto final purificado.
F. Estado gaseoso
La palabra gaseoso se enmarca en el grupo de los adjetivos y se utiliza para identificar a todas las sustancias que se encuentran en forma de gas o bien al líquidoque emana, posee o genera gases. Cuando el término aparece escrito en femenino(gaseosa), se emplea de manera específica para hacer referencia a una bebida efervescente carente de alcohol que se suele disfrutar como refresco.
El estado gaseoso de la materia es una forma de la materia en el que sus partículas se encuentran en un alto estado de energía, lo que hace que éstas vibren rápidamente, que experimenten una fuerte repulsión entre sí, y que tiendan a separarse lo más posible con un desplazamiento vectorial de gran velocidad hacia direcciones aleatorias. El estado gaseoso se reconoce como un estado de la materia entre el estado líquido (menores niveles de energía) y el plasma (mayores niveles de energía). Debido a que las partículas de un gas están ampliamente separadas entre sí, tendrán uniones intermoleculares más débiles que los líquidos y los sólidos. El estado gaseoso, junto con el plasma, es el estado más abundante en el universo, con algunas trazas de materia sólida, debido a que en su gran mayoría abundan fundamentalmente el Hidrógeno y el Helio.
F.1. Teoría cinética de los gases







La teoría cinética de los gases explica las características y propiedades de la materia en general, y establece que el calor y el movimiento están relacionados, que las partículas de toda materia están en movimiento hasta cierto punto y que el calor es una señal de este movimiento.
La teoría cinética de los gases considera que los gases están compustos por las moléculas, partículas discretas, individuales y separadas. La distancia que existe entre estas partículas es muy grande comparada con su propio tamaño, y el volumen total ocupado por tales corpúsculos es sólo una fracción pequeña del volumen ocupado por todo el gas. por tanto, al considerar el volumen de un gas debe tenerse en cuenta en primer lugar un espacio vacío en ese volumen.
El gas deja muchos espacios vacíos y esto explica la alta comprensibilidad, la baja densidad y la gran miscibilidad de unos con otros.
Hay que tener en cuenta que:
1. No existen fuerzas de atracción entre la moléculas de un gas.
2. Las moléculas de los gases se mueven constantemente en línea recta por lo que poseen energía cinética.
3. En el movimiento, las moléculas de los gases chocan elásticamente unas con otras y con las paredes del recipiente que las contiene en una forma perfectamente aleatoria.
4. La frecuencia de las colisiones con las paredes del recipiente explica la presión que ejercen los gases.
5. La energía de tales partículas puede ser convertida en calor o en otra forma de energía. pero la energía cinética total de las moléculas permanecerá constante si el volumen y la temperatura del gas no varían; por ello, la presión de un gas es constante si la temperatura y el volumen no cambian.
F.2. Unidades de presión, volumen y temperatura
Para describir el estado de cualquier gas, no sólo hay que decir qué volumen ocupa, sino que es necesario especificar también su temperatura y presión.
¿Qué es el Volumen?
Se denomina volumen de un cuerpo al espacio ocupado por dicho cuerpo. Las unidades más utilizadas para medir volúmenes son el centímetro cúbico, el mililitro y el litro. Para los gases, esta última unidad es la más empleada.
¿Qué es la Presión?
Una de las propiedades más importantes de un gas es la presión, la cual se ejerce igualmente sobre todas las partes del recipiente que lo contenga. La Presión se define como la fuerza ejercida por unidad de área, o sea:
P=F/a
Según esta ecuación, las unidades de presión serán: dinas (cm2), gramos, fuerza/cm2, libras/pulgada2, etc. Esta última se denomina en ingles, “pouds per square inch” por lo cual abrevia PSI, notación que es muy conocida.
¿Qué es la temperatura?
La temperatura es el grado de intensidad del calor y se mide utilizando diversas propiedades, entre las cuales la más empleada es la dilatación térmica.
Un gas puede licuarse por enfriamiento o por compresión (aplicando presiones altas). Sin embargo, este último proceso sólo puede verificarse cuando el gas se encuentra a temperaturas por debajo de la denominada Temperatura Crítica, la cual es la temperatura por encima de la cual es imposible licuar un gas por presión. En consecuencia, a temperatura mayores que la Crítica, una sustancia sólo puede existir como gas, no importa cuán alta sea la presión que se ejerza sobre ella.
F.3. Propiedades de los gases:
F.3.1. Expansión
Cuando un gas se expande puede efectuar trabajo sobre sus alrededores, y de igual forma, para comprimir un gas a volumen más pequeño, se debe efectuar trabajo externo sobre él. La cantidad real de trabajo efectuado en estos procesos no sólo depende de la ecuación de estado del gas, sino también de las condiciones en las que ocurre la expansión o la compresión, es decir, de que se realice a temperatura constante, o a presión constante, o sin flujo de calor, o de alguna otra manera.
Para ilustrar mejor este trabajo de expansión o compresión de un gas, imaginemos un gas cerrado dentro de un recipiente, una de cuyas paredes es un émbolo móvil (como el de una jeringa) pero sin masa ni rozamiento. Si se produce una variación del volumen del recipiente, el émbolo se desplazará una distancia Δx, ya que en su expansión el gas empuja el pistón contra la presión externa, que permanece constante.
F.3.2. Forma
Esto nos permite decir que el gas es el estado de agregación de una materia que carece de volumen y de forma propios, algo que le permite diferenciarse de un líquido o de un sólido.
A la hora de hablar de gas tenemos que determinar que varias son las señas de identidad que los identifican claramente respecto a otros tipos de fluido. Así, entre las mismas se encuentra el hecho de que existe una gran distancia de vacío entre las partículas que lo conforman lo que trae consigo que sea posible su comprensión.
De la misma forma también se establece que las citadas partículas se encuentran en todo momento en movimiento lo que supone que estén chocando contra las paredes de los recipientes que las contienen sobre las que ejercen presión.
Y todo ello sin olvidar tampoco el hecho de que cuando dos gases entran en contacto lo que se produce es una mezcla en la que partículas de ambos quedan perfecta y uniformemente repartidas. Esto se consigue tanto al citado movimiento que las mismas tienen en todo momento como al granespacio que existe entre ellas.
El término se utiliza, de forma genérica, para referirse a los gases capaz de generar combustión y que se utilizan en el hogar o la industria. Por ejemplo: “Cuidado con esa hornalla que tiene poco gas y no cocina bien”, “Tenemos que pagar el gas o lo van a cortar y nos tendremos que duchar con agua fría”, “Una fuga de gas causó la explosión”.
El gas, por otra parte, es la combinación entre aire y un producto carburante que sirve para poner en funcionamiento un motor: “Tengo que cargar gas al coche así podemos llegar a la playa sin problema”, “Quiero comprarme un auto que funcione a gas porque es más barato que la nafta”.
Gracias a su capacidad como combustible, la noción de gas se emplea, en sentido figurado, como sinónimo de impulso, fuerza o arranque: “A este equipo hay que darle gas, no puede ser que pierda tres partidos seguidos como local”, “Me hace falta gas, no aguanto otra noche despierto por culpa del estudio”.
Actualmente podemos establecer que nos encontramos con una gran variedad de gases. Así, por ejemplo, se habla de lo que se da en llamar gas ciudad que es aquel que se distribuye por redes urbanas para lograr que en cada hogar exista el combustible necesario para poder llevar a cabo acciones como cocinar o disfrutar de agua caliente.
De la misma forma, está el gas hilarante que se define porque tiene una serie de características o propiedades de tipo anestésico.
Este término, además de todo lo citado, se emplea en una serie de expresiones populares como “a todo gas” con la que se viene a decir que una persona o un vehículo se encuentran funcionando a una gran velocidad.
Cabe destacar, por último, que se conoce como gas a todos aquellos gases que se generan en el aparato digestivo. Las flatulencias son las mezclas gaseosas expulsadas a través del ano que disponen de un sonido y de un olor muy particulares.
F.3.3. Presión
Los gases ejercen presión sobre cualquier superficie con la que entren en contacto, ya que las moléculas gaseosas se hallan en constante movimiento. Al estar en movimiento continuo, las moléculas de un gas golpean frecuentemente las paredes internas del recipiente que los contiene. Al hacerlo, inmediatamente rebotan sin pérdida de energía cinética, pero el cambio de dirección (aceleración) aplica una fuerza a las paredes del recipiente. Esta fuerza, dividida por la superficie total sobre la que actúa, es la presión del gas.
Definición de presión: La presión se define como una fuerza aplicada por unidad de área, es decir, una fuerza dividida por el área sobre la que se distribuye la fuerza.
Presión = Fuerza / Área
La presión de un gas se observa mediante la medición de la presión externa que debe ser aplicada a fin de mantener un gas sin expansión ni contracción.
Para visualizarlo, imaginen un gas atrapado dentro de un cilindro que tiene un extremo cerrado por en el otro un pistón que se mueve libremente. Con el fin de mantener el gas en el recipiente, se debe colocar una cierta cantidad de peso en el pistón (más precisamente, una fuerza, f) a fin de equilibrar exactamente la fuerza ejercida por el gas en la parte inferior del pistón, y que tiende a empujarlo hacia arriba. La presión del gas es simplemente el cociente f / A, donde A es el área de sección transversal del pistón.
F.3.4. Densidad
El aire tiene una densidad a una temperatura de 0ºC (273,15 K) y 1 atmósfera de presión es de 1,29 g/L [1].
Sabemos que, cuando un gas es más denso que el aire, este se acumula en la parte inferior y que, por el contrario, si es menos denso se acumula en la parte superior. Este es, por ejemplo, el motivo de que en un incendio lo gente avance agachada o arrastrándose por el suelo: el monóxido de carbono, un gas altamente asfixiante (puedes leer nuestra entrada sobre la muerte dulce aquí) es menos denso que el aire y esto hace que en la parte inferior de la estancia su concentración sea inferior.
Ahora bien, cabe preguntarse, ¿cómo podemos saber si un gas va a ser más o menos denso que el aire? Dicho de otro modo: ¿podemos calcular de forma teórica la densidad de un gas? La respuesta es que sí. De forma aproximada, podemos utilizar la ley de los gases ideales y realizar algunos cálculos estequiométricos para calcular la densidad de un gas. A continuación vemos cómo podemos deducir la densidad del gas a partir de dicha expresión. Para ello, recordemos que el número de moles es igual a m/M, donde m es la masa presente y M la masa molecular del gas, y la densidad es m/V.
Es decir, la densidad se puede calcular conociendo la presión (P, en atm), la masa molecular del gas (M, g/mol), la constante de los gases ideales (R, atm·L/K·mol) y la temperatura (en K). Esta fórmula implica, por tanto, que a unas determinadas condiciones de presión y temperatura, la densidad de un gas depende únicamente de su masa molecular, siendo ambas magnitudes directamente proporcionales. De este modo, los gases con masas moleculares menores que la media ponderada del aire serán menos densos que éste, y los gases con masas moleculares mayores serán más densos.
Por ejemplo, calculemos el caso del monóxido de carbono, CO, en las mismas condiciones de presión y temperatura.
d = (1 atm · 28g/mol) / (0,082 (atm·L/K·mol)·273 K) = 1,25 g/L
Como vemos, aunque no es mucha la diferencia, es en efecto menos denso que el aire, cuya densidad es, como hemos indicado previamente, de 1,29 g/L en estas mismas condiciones.
Considerando un gas más pesado, que será por tanto más denso que el aire, como el hexafluoruro de azufre (SF6), y cuya masa molecular es de 146 g/mol, su densidad será muchísimo mayor:
d = (1 · 146) / (0,082 · 273) = 6,52 g/L [2]
Por tanto, basta con conocer M, la masa molecular de un gas, para calcular de forma aproximada su densidad a unas determinadas condiciones.
F.3.5. Miscibilidad
Miscibilidad es un término usado en química que se refiere a la propiedad de algunos líquidos para mezclarse en cualquier proporción, formando una disolución. En principio, el término es también aplicado a otras fases (sólidos, gases), pero se emplea más a menudo para referirse a la solubilidad de un líquido en otro. El agua y eletanol (alcohol etílico), por ejemplo, son miscibles en cualquier proporción.
Por el contrario, se dice que las sustancias son inmiscibles si en alguna proporción no son capaces de formar una fase homogénea. Por ejemplo, el éter etílico es en cierta medida soluble en agua, pero a estos dos solventes no se les considera miscibles dado que no son solubles en todas las proporciones.
F.4. Leyes de los Gases:
F.4.1. Boyle-Mariotte
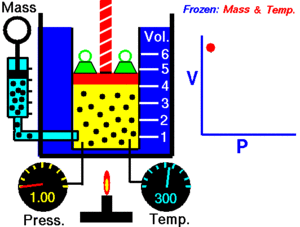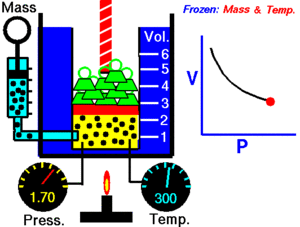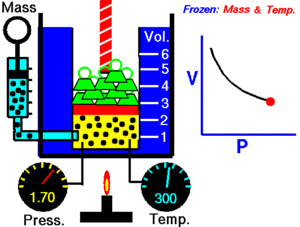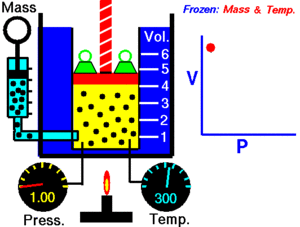
Un gas ideal es aquel que cumple unas condiciones determinadas expresadas en forma de leyes simples, que veremos a continuación. Muchos gases se comportan como ideales a baja presión. Históricamente, la primera de las leyes de los gases ideales se debe al inglés Boyle y al francés Mariotte e indica que, para una temperatura determinada, el producto de la presión P por el volumen V de un gas permanece constante K: P V = K Por tanto, la presión es inversamente proporcional al volumen o viceversa. P = K / V V = K / P Ambas expresiones corresponden a la ecuación de una hipérbola. La gráfica muestra líneas de (V, P) para distintas temperaturas. En cada hipérbola la temperatura permanece constante y se llama isoterma.
Vamos a comprobar la ley de Boyle-Mariotte a distintas temperaturas. Manteniendo fija la temperatura, la representación gráfica de los pares de puntos (V, P) se llama isoterma, y corresponde a una hipérbola. P V = K Completa los datos de las tres tablas adjuntas después de seleccionar la temperatura en el deslizador de la parte inferior de la pantalla, tomando el valor directamente del manómetro de rejoj. Cada uno de los puntos los determinas desplazando el deslizador de la presión. Calcula la K de cada punto y su valor medio Km.
F.4.2. Charles
La Ley de Charles es una Ley de los gases que nos dice que, a presión y número de moles constantes, el volumen y la temperatura varía pero manteniendo la división V / T constante. Es decir que V / T es siempre igual a una constante k
V / T = k
De aqui se desprende lo siguiente
V1 / T1 = V2 / T2
Donde 1 indica "estado inicial", y 2 indica "estado final"
La ley de charles se desprende de la Ley de los gases ideales
P · V = R · n · T
Donde
P = presión
V = volumen
R = constante de los gases = 0,0821 [atm L / mol K]
n = número de moles
T = temperatuta absoluta (temperatura en Kelvin)
Recuerda que la Ley de Charles se usan para los gases con presión y número de moles constante. Entonces
P · V / T = R · n
V / T = R · n / P = k
Como R, n y P son constantes, entonces por eso la división de volumen entre temperatura se mantiene constante
Se dice que V es directamente proporcional a T ya que
V / T = k
V = k · T
Donde k es la constante de proporcionalidad entre ambas variables.
F.4.3. Gay-Lusaac
Joseph Louis Gay-Lussac fue un físico francés que en el año de 1802 observó que todos los gases se expanden a una misma fracción de volumen para un mismo aumento en la temperatura, lo que le reveló la existencia de un coeficiente de expansión térmica común.
La ley de Gay- Lussac establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
F.4.4. Ley Combinada
La ley general de los gases o ley combinada dice que una masa de un gas ocupa un volumen que está determinado por la presión y la temperatura de dicho gas. Estudia el comportamiento de una determinada masa de gas si ninguna de esas magnitudes permanece constante.
Esta ley se emplea para todos aquellos gases ideales en los que el volumen, la presión y la temperatura no son constantes. Además la masa no varía. La fórmula de dicha ley se expresa: (V1 * P1) / T1 = (V2 * P2) / T2 Es decir, el volumen de la situación inicial por la presión original sobre la temperatura es igual a el volumen final por la nueva presión aplicada sobre la temperatura modificada.
La presión es una fuerza que se ejerce por la superficie del objeto y que mientras más pequeña sea ésta, mayor presión habrá
A partir de la ley combinada podemos calcular la forma como cambia el volumen o presión o temperatura si se conocen las condiciones iniciales (Pi,Vi,Ti) y se conocen dos de las condiciones finales (es decir, dos de las tres cantidades Pt, Vt, Tf).